各物质之间的转换关系如下图,部分生成物省略。、是由、、中两种元素组成的化合物,、、的原子序数依次增大,在周期表中的原子半径最小,、原子量外层电子数之和为10。为无色非可燃性气体,为黄绿色单质气体,、为金属,有漂白作用,反应①常用于制作印刷电路板。



 请回答下列问题:
请回答下列问题:
 (1)写出的化学式, 的电子式。
(1)写出的化学式, 的电子式。
 (2)比较与的原子半径大小> (填写元素符号)。
(2)比较与的原子半径大小> (填写元素符号)。
 (3)写出反应②的化学方程式(有机物用结构简式表示),举出该反应的一个应用实例。
(3)写出反应②的化学方程式(有机物用结构简式表示),举出该反应的一个应用实例。
 (4)已知溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式。
(4)已知溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式。
 (5)研究表明:气体在一定条件下可被还原为晶莹透明的晶体,其结构中原子的排列为正四面体,请写出及其2种同素异形体的名称、、。
(5)研究表明:气体在一定条件下可被还原为晶莹透明的晶体,其结构中原子的排列为正四面体,请写出及其2种同素异形体的名称、、。
某化学兴趣小组对坚铝(主要成分是Al、Mg、Cu等)进行如下图所示的实验。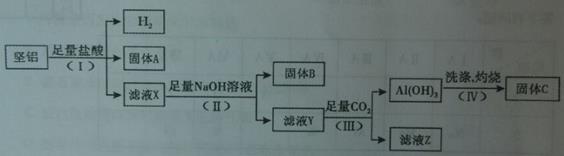
(1)(I)和(II)步骤中分离溶液和沉淀的操作名称是 ;
(2)固体A中主要含有 ;固体B是 (填化学式);
(3)滤液Y中的阴离子除OH—、Cl—外,还有 ;
(4)写出(IV)步骤反应的化学方程式: 。
完成下列各题。
(1)写出木炭与浓硫酸在加热条件下反应的化学方程式: 。
(2)乙醇(C2H5OH)是一种优良燃料,写出它在空气中完全燃烧的化学方程式: 。
下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。
| 周期族 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
N |
O |
F |
Ne |
||||
| 3 |
Na |
Mg |
Al |
Si |
S |
Cl |
(1)非金属性最强的元素是 ;
(2)Ne原子结构示意图为 ;
(3)N和O中,原子半径较小的是 ;
(4)H2S和HCl中,热稳定性较强的是 ;
(5)MgO和Al2O3中,属于两性氧化物的是 ;
(6)元素最高价氧化物对应的水化物中,碱性最强的是 (填化学式);
(7)SiO2常用于制造 (填一种高性能的现代通讯材料的名称);
(8)誉称为“绿色氧化剂”的过氧化氢,它的化学式是 ,其中氢元素与氧元素的质量比为m(H):m(O)= ;(相对原子质量:H—1,O—16)
(9)镁是制造汽车、飞机、火箭的重要材料。写出工业上电解熔融氯化镁获得金属镁的化学方程式: 。
从A甲烷 B甲醛 C乙酸 D油脂 E纤维素 F聚乙烯,六种有机物中选择合适的物质,将其标号填在横线上。
(1)天然气的主要成分是 ;
(2)可制成食品保鲜膜或保鲜袋的是 ;
(3)食醋可作为增加食品酸味的调味剂,是因为其中含有 ;
(4)新装修的家居中会散发出苯、 等挥发性的有害物质;
(5)可作为制造肥皂原料的是 ;
(6)棉花、甘蔗渣的主要成分是 。
完成下列各题。
(1)茶叶中含有茶多酚,它具有消毒、杀菌、抗衰老、抗辐射等功能。其中一种成分的化学式为C17H19N3O,它属于 (填“有机物”或“无机物”)。
(2)小郑体检的血液化验单中,“葡萄糖”一项的检测结果为4.91×10—3mol·L-1。这里的“4.91×10—3mol·L-1”表示葡萄糖的 (填“溶质质量分数”或“物质的量浓度”)。