 已知周期表中,元素、、、与元素相邻。的最高化合价氧化物的水化物是强酸。回答下列问题:
已知周期表中,元素、、、与元素相邻。的最高化合价氧化物的水化物是强酸。回答下列问题:
 (1)与可以形成一种高温结构陶瓷材料。的氯化物分子呈正四面体结构,的氧化物的晶体类型是;
(1)与可以形成一种高温结构陶瓷材料。的氯化物分子呈正四面体结构,的氧化物的晶体类型是;
 (2)的具有相同化合价且可以相互转变的氧化物是;
(2)的具有相同化合价且可以相互转变的氧化物是;
 (3)和形成的二价化合物中,呈现最高化合价的化合物是化学式是;
(3)和形成的二价化合物中,呈现最高化合价的化合物是化学式是;
 (4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式),其原因是
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式),其原因是 ②电子总数相同的氢化物的化学式和立体结构分别是
②电子总数相同的氢化物的化学式和立体结构分别是
 (5)和所形成的结构陶瓷材料的一种合成方法如下:的氯化物与的氢化物加热反应,生成化合物和气体;在高温下分解生成的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
(5)和所形成的结构陶瓷材料的一种合成方法如下:的氯化物与的氢化物加热反应,生成化合物和气体;在高温下分解生成的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
钠放入到硫酸铜溶液中,现象是________,离子方程式为______。
在Fe、S2—、SO2、H+、Na+、S、Fe2+等物质或粒子中:
(1)只能被氧化,不能被还原的是;
(2)只能被还原,不能被氧化的是;
(3)既能被氧化,又能被还原的是。
在反应2F2+2H2O=4HF+O2中,作还原剂,元素被氧化;在反应Ca+2H2O=Ca(OH)2+H2↑中,作氧化剂,元素被还原。若在两个反应中,电子转移的物质的量相等时,产生氢气和氧气的质量比为。
已知化合物A、D、E、G焰色反应时,火焰均呈黄色,其中A可用作家庭食品添加剂,也可用以治疗胃酸过多。A~H各物质的变化关系如下图所示。
(1)写出各步反应的化学方程式
反应①反应②
反应③反应④
反应⑤
(2)上述反应中属于氧化还原反应的有
氨的合成原理为:N2(g)+3H2(g) 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
回答下列问题:
(1)10 min内以NH3表示的平均反应速率;
(2)在10 ~20 min内:NH3浓度变化的原因可能是;
| A.加了催化剂 | B.缩小容器体积 | C.降低温度 | D.增加NH3物质的量 |
(3)第1次平衡的时间范围为:,第2次平衡的时间范围为:,
第1次平衡:平衡常数K1 = (带数据的表达式),第2次平衡时NH3的体积分数;
(4)在反应进行至25 min时:
①曲线发生变化的原因:
②达第二次平衡时,新平衡的平衡常数K2K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= 。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) 2NH3(g) +
2NH3(g) + 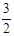 O2(g);△H =" a" kJ·mol—1
O2(g);△H =" a" kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a0;ΔS0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g) 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为: