(9分)(1)已知:N N的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式 ;
N的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式 ;
该反应的熵变△S 0(填“>”、“<”或“=”)。
(2)将1 mol N2与3 mol H2混合置于容积为10 L的密闭容器中。
①温度为T1时,混合气体中氨的物质的量分数为25%,则N2的转化率为 。
②当温度由T1变化到T2 (T2 >T1)时(如图),平衡常数KA KB(填“>”、“<”或“=”)。
③温度在T1时,若起始时向10L密闭容器中加入N2 0.5 mol、H2 1.5 mol、NH3 1 mol。当反应达到平衡时,与起始时比较, (填化学式)的物质的量增加。
(1)小苏打是某种治疗胃酸过多的胃药的主要成分,请写出该反应的离子方程式:。
(2)在海水提溴过程中,吸收塔中用SO2和H2O将Br2转化成氢溴酸以达到富集的目的,请写出化学方程式:。
(3)(NH4)2Fe(SO4)2属于盐类,溶于水后会电离出NH4+和Fe2+,写出检验的操作和现象:
a:检验Fe2+:取少量样品于试管中,;
b:检验NH4+ :取适量样品于试管中,。
选择适当的试剂,除去以下物质中的杂质:
(1)苯中的甲苯;
(2)乙醇中的水;
(3)乙酸乙酯中的乙酸。
四苯基乙烯是一种在建筑及医疗设备、包装和电器制造中使用的化合物,结构如图。它的一氯代物有种,分子中能共面的碳原子最多有个。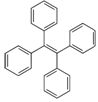
写出下列反应的化学方程式:
(1)乙烯与水反应:。
(2)把浓溴水滴入苯酚溶液中:。
(3)溴乙烷与NaOH的乙醇溶液共热:。
(4)CH2=CHCOOCH2CH3的聚合反应:。
请按要求回答下列问题:
(1)非诺洛芬是治疗类风湿性关节炎的药物,其结构简式为 。它的含氧官能团名称为,能发生的有机反应类型有。
。它的含氧官能团名称为,能发生的有机反应类型有。
(2)4-甲基-2-戊烯的结构简式为。