(8分) (1)1971年美国的斯图杰尔和阿佩里曼在0℃ 以下将氟气从细冰末上通过,成功地合成了一直认为不存在的氟的含氧酸——次氟酸。
①写出次氟酸的结构并标出各元素的化合价__________________;
②次氟酸刹那间被热水分解得到既可表现氧化性(对NaI)又可表现还原性(对KMnO4)的溶液,写出次氟酸分解 反应的化学方程式:____________________________。
反应的化学方程式:____________________________。
(2) 氰(CN)2的化学性质与卤素(X2)很相似称为拟卤素,氰能和氢气反应生成HCN,其水溶液是一种酸。氰的氧化性比溴弱、比碘强。
①HCN分子中含有4个共价键,写出HCN的结构式:_______ ;
②下列有关方程式不正确的是____________。
A. (CN)2+2NaOH===NaCN+NaCNO+H2O (CN)2+2NaOH===NaCN+NaCNO+H2O |
|
| B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O | C.I2+2KCN===2KI+(CN)2 |
| D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2 |
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 |
Na+ |
K+ |
Ca2+ |
Mg2+ |
Cl- |
SO42- |
HCO3- |
| 含量/mg·L-1 |
9 360 |
83 |
200 |
1 100 |
16 000 |
1 200 |
118 |
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。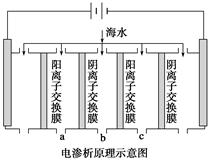
①阴极的电极反应式为__________________。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式______________________________________。
③淡水的出口为a、b、c中的________出口。
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示: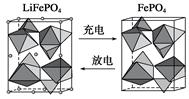
该电池电解质为传导Li+的固体材料。放电时该电极是电池的________极(填“正”或“负”),电极反应式为______________________。
某小组按图1所示的装置探究铁的吸氧腐蚀。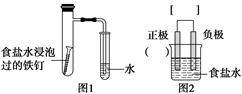
完成下列填空:
(1)图2是图1所示装置的示意图,在图2的小括号内填写正极材料的化学式;在方括号内用箭头表示出电子流动的方向。
(2)写出正、负极反应的方程式。
正极:________________,负极:________________。
(3)按图1装置实验,约8分钟才看到导管中液柱上升,下列措施可以更快更清晰地观察到液柱上升的是____________________(填字母序号)。
a.用纯氧气代替具支试管内的空气
b.用食盐水浸泡过的铁钉再蘸取铁粉和炭粉的混合物
c.用毛细尖嘴管代替玻璃导管,并向试管的水中滴加少量红墨水
(4)升高温度可以加快化学反应速率,建议用酒精灯加热具支试管。这一措施________(填“可行”或“不行”)。
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题: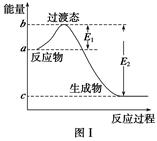

(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:________________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1
②CH3OH(g)+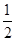 O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为______________________。
(3)如表所示是部分化学键的键能参数:
| 化学键 |
P—P |
P—O |
O=O |
P=O |
| 键能/kJ·mol-1 |
a |
b |
c |
x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=________ kJ·mol-1(用含a、b、c、d的代表数式表示)。
根据下列条件计算有关反应的焓变:
(1)已知:Ti(s)+2Cl2(g)=TiCl4(l)ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)=2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)=Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的ΔH=________ kJ·mol-1。
(2)已知下列反应数值:
| 反应序号 |
化学反应 |
反应热 |
| ① |
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) |
ΔH1=-26.7 kJ·mol-1 |
| ② |
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) |
ΔH2=-50.8 kJ·mol- |
| ③ |
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) |
ΔH3=-36.5 kJ·mol-1 |
| ④ |
FeO(s)+CO(g)=Fe(s)+CO2(g) |
ΔH4 |
则反应④的ΔH4=____________ kJ·mol-1。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
请回答下列问题:
(1)该反应的热化学方程式为_______________________________________________。
(2)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与双氧水反应生成液态水时放出的热量是________ kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________________________________________________________________。