I.元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3 :4,且M原子的质子数是Y原子的2倍;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)写出Y、Z、N按原子个数之比1 :1:1形成的化合物的电子式_______________。
(2)写出由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子发生氧化还原反应的离子方程式:_________________。
(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________。
Ⅱ.A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3的型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
(4)D元素在元素周期表中的位置是_____。B与D所形成的化合物的化学键类型为______。
(5)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为_。
Ⅰ、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的
放电电压。高铁电池的总反应为
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
(1) 放电时正极附近溶液的碱性 (填增强、减小或不变);放电时每转移3 mol 电子,有 molK2FeO4被(填氧化或还原)
(2)电池充电时阳极反应为
Ⅱ、下列框图中,A由两种黑色金属氧化物等物质的量混合而成,B中含有四种阳离子.据此回答下列问题:
(1)A的组成是(填化学式)
(2)相同条件下,溶液B中所有阳离子的氧化性由强到弱的顺序依次是
(3)A中某组分可由单质与水反应制得,化学方程式为:
(4)电解所用装置如右图所示
电解开始阶段,阳极上的电极反应是
电解至阴极刚开始有固体R析出时,该溶液中金属离子浓度由大到小的顺序是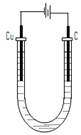
磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4的废液)为原料来制备磁材氧化铁。
已知:煅烧中的化学反应方程式为:FeCO3 → FeO + CO2↑,4FeO + O2 → 2Fe2O3
(1)用98%的H2SO4的配制500mL的20%的H2SO4,所需玻璃仪器是
| A.玻璃棒 | B.烧杯 | C.漏斗 | D.250mL容量瓶 |
E.500mL容量瓶 F.胶头滴管
(2)浓缩结晶后得到的晶体是 (填化学式),A中溶质是 ;此溶液中各
离子的浓度比较大小为: 。
(3) 20%H2SO4和铁皮的作用分别是 。
(4)检验滤液中含有NH4+的方法是 。
(5)写出步骤“合成”中发生的化学变化(用化学方程式表示): 。
已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。
(1)95 ℃时水的电离平衡曲线应为 (填“A”或“B”),理由是 。
(2)曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH 7。
(3)在曲线B所对应的温度下,将0.02 mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH= 。
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化: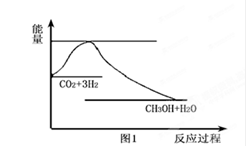
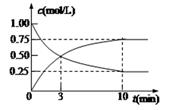
图2
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)= ;
②下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式: 。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极的电极反应式是: 。
已知某无色透明溶液中仅含有包括Na+和CH3COO— 在内的四种离子。
请回答下列问题。
(1)该溶液中的溶质可能有三种情况,请分别写出各种情况的化学式:
① ;② ; ③ 。
(2)用离子方程式表示CH3COONa溶液显碱性的原因: ;
(3)当溶液中各离子浓度大小的顺序为c(CH3COO—)>c(Na+)>c(H+)>c(OH—)时,则该溶液可能是 (填序号);
A.由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成
B.由0.1mol/L的CH3COONa溶液与0.1mol/L的NaOH溶液等体积混合而成
C.由0.1mol/L的CH3COONa溶液与0.1mol/L的CH3COOH溶液等体积混合而成
(4)当该溶液中溶质为两种,且溶液呈碱性时,四种离子的物质的量浓度由大到小的排列顺序可能为(写出两种):① 、 ② 。