(普通班做)
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: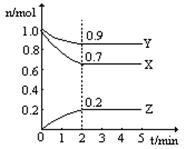
(1)该反应的化学方程式为 ;
(2)从开始至2min,Z的平均反应速率为 ;
平衡时,X的转化率为 ;平衡时,Y的浓度为 ;
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A容器内压强不再发生变化
B X的体积分数不再发生变化
C容器内气体原子总数不再发生变化
D相同时间内消耗2n mol的Z的同时消耗n mol的Y
E. 相同时间内消耗n mol的Y的同时消耗3n mol的X
22.如图示实验中,把四根洁净的金属条A、B、C、D轮流放置在没有盐溶液的滤纸上面并压紧。在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如右表)。
(1)金属可能是最强的还原剂;
(2)金属不能从硫酸铜溶液中置换铜。
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1)图中通过负载的电子流动方向(填“向左”或“向右)
(2)写出氢氧燃料电池工作时电极反应方程式和总反应方程式
正极:_____________________负极:
总反应:____________________
(3)为了获得氢气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和H2O反应生成H2和CO的化学方程式:
__________________________________
(4)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,
负极反应式为
电池总离子反应方程式为
已知:合成氨反应为N2+3H2 2NH3(正反应为放热反应),分析下列问题:
2NH3(正反应为放热反应),分析下列问题:
(1)在一定温度时,可用图中哪一条曲线表示反应物的转化率和压强之间的关系(填“I”“II”“III”)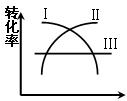
(2)在不同温度和压强下(P1>P2),合成氨反应达到平衡时,混合气体中氨气的体积分数Z%
随温度变化的曲线应为(填“A”“B”“C”“D”)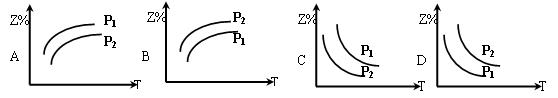
(3)将N2和H2按1:3的体积比通入合成塔,反应达平衡后,NH3的体积分数为20%,则达到平衡时,N2和H2的转化率之比α(N2)∶α (H2)= ;平衡时N2的转化率为_________;平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =
某反应的平衡常数表达式为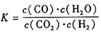 ,恒容时,温度升高.H2浓度减小。分析下列问题:
,恒容时,温度升高.H2浓度减小。分析下列问题:
(1)该反应的化学方程式为:
(2)温度升高,该反应的K值______________(填“增大”“减小”或“不变”),化学平衡移动后达到新的平衡,CO2和CO体积比_______________(填“增大”“减小”或“不变”)。
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min),850℃的化学平衡常数的值K=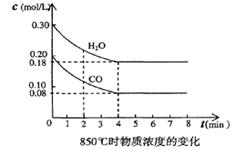
(4)850℃时,在相同容器中发生反应CO2+ H2 CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正)v(逆)(“大于”“ 小于”“等于”)
CO+H2O (g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气 0.08 mol/L,此时v(正)v(逆)(“大于”“ 小于”“等于”)
把煤作为燃料可通过下列两种途径:
|
|
|
|
 2CO(g)+O2(g) ="==" 2CO2(g)
2CO(g)+O2(g) ="==" 2CO2(g)