在2 L密闭容器内,800℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=__________。已知K300℃>K350℃,则该反应是________热反应。
(2)如图中表示NO2变化曲线的是__________,用O2表示从0 s~2 s 内该反应的平均速率v=________。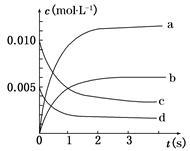
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=_________。已知:K(300℃)>K(350℃),该反应是________热反应。
(2)下图中表示NO2的变化的曲线是______。用O2表示从0~2s内该反应的平均速率v=___________。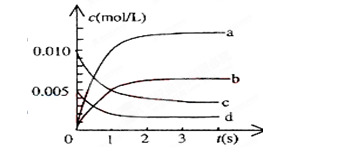
(3)能说明该反应已经达到平衡状态的是___________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
在密闭容器中进行可逆反应: CO(g)+NO2(g) CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通入CO2气体,平衡 移动,反应混合物的颜色 。
若通入N2气体,平衡 移动,反应混合物的颜色 。
③加入催化剂,平衡 移动。
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1) Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
(3)X2M的燃烧热ΔH= -a kJ·mol-1,写出X2M燃烧热的热化学方程式: _________________________。
(4)ZX的电子式为______;ZX与水反应放出气体的化学方程式为_____________。
(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:2Z + FeG2  Fe + 2ZG
Fe + 2ZG 
放电时,电池的正极反应式为_____________:充电时,____________(写物质名称)电极接电源的负极;该电池的电解质为___________________。
有机物A(C12H15ClO3)为含多种官能团的芳香族化合物,其结构简式如图(其中虚线框内为未知部分的结构)所示,A可发生如下转化(其中部分产物已略去)。
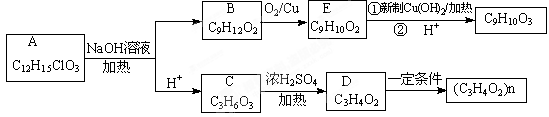
已知:D能使溴的CCl4溶液褪色;B不能与FeCl3溶液发生显色反应,1mol B最多能与2mol金属钠反应;C的催化氧化产物不能发生银镜反应。回答下列问题。
(1)写出C中官能团的名称_______________________。
(2)A的结构简式(写出一种):_________________________。
(3)写出反应类型:C→D________;B→E________。
(4)写出E与新制Cu(OH)2反应的化学方程式_____________________________________。
(5)E有多种同分异构体,满足下列条件的同分异构体有________种,写出其中任意一种同分异构体的结构简式____________。
①含有苯环且苯环上只有一个取代基;②分子结构中含有甲基;③能发生水解反应。
A~F六种有机物的相互转化关系如图所示:
据此回答下列问题:
(1)A是合成天然橡胶的单体,用系统命名法命名,A的名称为__________________,天然橡胶的结构简式为_______________。
(2)A生成 时,A发生的反应类型为____________。
时,A发生的反应类型为____________。
(3)E→F的化学方程式为__________________________。
(4)A与Br2按物质的量比1∶1发生加成反应,生成的产物有_______种(考虑顺反异构)。
(5)现有另一种有机物G,已知G与E无论按何种比例混合,只要总质量一定,完全燃烧时生成的CO2、H2O以及消耗的O2均为定值。请写出两种符合下列要求的G的结构简式___________、__________。
①M(G)<M(E);
②G的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1∶3。