在密闭容器中进行可逆反应: CO(g)+NO2(g) CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通入CO2气体,平衡 移动,反应混合物的颜色 。
若通入N2气体,平衡 移动,反应混合物的颜色 。
③加入催化剂,平衡 移动。
(13分) A、B、C、D四种芳香族化合物,它们的结构简式如下所示:
请回答下列问题:
(1)D中含氧官能团的名称是________________________。
(2)能与新制Cu(OH)2反应产生红色沉淀的是________________(填序号)。
(3)A不能发生的反应是________________(填序号)。
①取代反应②加成反应③消去反应④加聚反应⑤与盐酸反应
(4)等物质的量的B、C与足量的NaOH溶液反应,消耗的NaOH物质的量之比为________。
(5)A在一定条件下可以生成一种高分子化合物E,E的结构简式为_________________。
(6)请写出D与CuO反应的化学方程式:_______________________________________。
在短周元素中,金属性最强的元素是,最高价氧化物对应的水化物的酸性最强的元素是,最高价氧化物对应的水化物呈两性的元素是,该元素的氧化物对应的水化物与盐酸发生反应的离子方程式为。
通常羟基与烯键碳原子相连时,发生下列转化: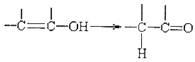
已知有机物A是由C、H、O三种元素组成。原子个数比为2:3:1,其蒸气密度为相同状况下H2密度的43倍,E能与NaOH溶液反应,F转化为G时,产物只有一种结构,且G能使溴水褪色。现有下图所示的转化关系: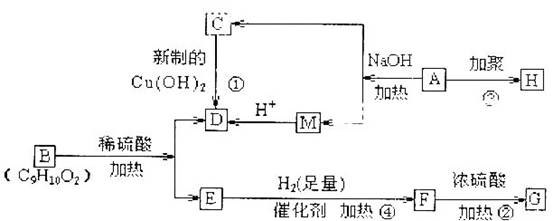
回答下列问题:
(1)写出下列所属反应的基本类型:①,④。
(2)写出B、C的结构简式:B,C。
(3)写出下列化学方程式:反应②。
反应③。
(4)写出所有符合下列条件的B物质的同分异构体
a.含有苯环 b.苯环上只含有一个支链 c.可与NaHCO3溶液反应放出CO2
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属,K是一种红棕色气体,D的俗名叫铁红, A是形成酸雨的主要气体。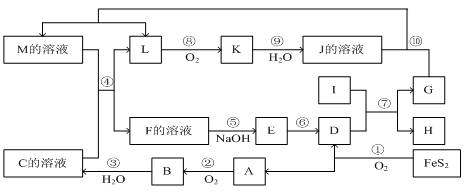
请填写下列空白:
(1)推导出下列物质的化学式:
C:E:
(2)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________(填写序号)。
(3)在反应⑨中氧化剂与还原剂的物质的量之比为___________________。
(4)反应⑦的化学方程式是:
(5)反应④的离子方程式是:_______________________________________
A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同一周期也不在同主族,B、C、 D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:
(1)A和D的氢化物中,沸点较低的是_____________(选填“A”或“D”);A和B的离子中,半径较小的是_______________(填离子符号)。
(2)元素C在元素周期表中的位置_______周期_________族。
(3)已知:晶体的最小重复单位称为“晶胞”。A和E可形成离子化合物,其晶胞结构如图,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)均位于小正方体中。该化合物的电子式__________________。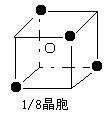
(4)写出B、C两元素各自对应的最高价氧化物的水化物相互反应的离子方程式。