A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同一周期也不在同主族,B、C、 D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:
(1)A和D的氢化物中,沸点较低的是_____________(选填“A”或“D”);A和B的离子中,半径较小的是_______________(填离子符号)。
(2)元素C在元素周期表中的位置_______周期_________族。
(3)已知:晶体的最小重复单位称为“晶胞”。A和E可形成离子化合物,其晶胞结构如图,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)均位于小正方体中。该化合物的电子式__________________。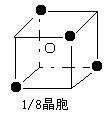
(4)写出B、C两元素各自对应的最高价氧化物的水化物相互反应的离子方程式 。
(6分)完成下列反应的化学方程式或要求:
(1)写出电解饱和食盐水制氯气的化学反应方程式:。
(2)写出电解熔融氯化镁制取金属镁的化学反应方程式:。
(3)用双线桥标出下述反应中电子转移的方向和数目 C + 4HNO3(浓)
C + 4HNO3(浓) 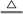 CO2↑ + 4NO2↑+2H2O
CO2↑ + 4NO2↑+2H2O
(13分)(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s) + O3(g) = 3Ag2O(s)ΔH1
已知2Ag2O(s) =" 4Ag(s)" + O2(g)ΔH2
则常温下反应: 2O3(g) = 3O2(g)的ΔH=(用ΔH1和ΔH2表示).
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应:
CH4(g) +2NO2(g)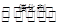 N2(g) +CO2(g) +2H2O(g)
N2(g) +CO2(g) +2H2O(g)
在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2) / n(CH4)] |
400 K |
500 K |
600 K |
| 1 |
60% |
43% |
28% |
| 2 |
45% |
33% |
20% |
①写出该反应平衡常数的表达式K = 。
②若温度不变,提高[n(NO2) / n(CH4)]投料比,则NO2的平衡转化率。(填“增大”、“减小”或“不变”。)
③由上表可知该可逆反应的正反应是反应。
④400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数。
(3)下图为连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图。则NiO电极上NO发生的电极反应式为:。
(7分)2SO2(g) + O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH=" —99" kJ·mol-1。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH=" —99" kJ·mol-1。
请回答下列问题: (1)已知图中C 点表示2mol SO3(g)的总能量,则A点表示:;E所代表的能量是;E的大小对该反应的反应热影响。(填“有”或“无”)。
(1)已知图中C 点表示2mol SO3(g)的总能量,则A点表示:;E所代表的能量是;E的大小对该反应的反应热影响。(填“有”或“无”)。 (2)图中△H=kJ·mol-1。
(2)图中△H=kJ·mol-1。
(9分) 观察下列几个装置示意图,有关叙述正确的是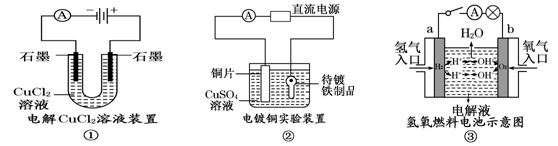
(1)在①图中,发生反应的化学方程式为:。
(2)在②图中,待镀铁制品应与电源极相连,电极反应式为:。
(3)在③图中,外电路电子由极流向极,若电解液为KOH溶液,则b极的反应式为。
(1)FeCl3的水溶液呈____(填“酸”、“中”、“碱”)性,实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以____(填“促进”、“抑制”)其水解。
(2)氯化铝溶于水的反应(用离子方程式表示):_______________________;把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是。
(3)物质的量浓度均为0.10 mol·L-1的三种溶液:a.CH3COONa b.Na2CO3c.NaHCO3
pH由小到大排列的顺序是(用编号填写)。
(4)NaHCO3溶液显性,原因是_______________________(用离子方程式表示)。