(6分)完成下列反应的化学方程式或要求:
(1)写出电解饱和食盐水制氯气的化学反应方程式: 。
(2)写出电解熔融氯化镁制取金属镁的化学反应方程式: 。
(3)用双线桥标出下述反应中电子转移的方向和数目 C + 4HNO3(浓)
C + 4HNO3(浓) 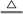 CO2↑ + 4NO2↑+2H2O
CO2↑ + 4NO2↑+2H2O
现有四个无标签的试剂瓶,分别盛有硫酸、BaCl2溶液、盐酸和不知名称的某正盐溶液M,将四种试剂分别标为A、B、C、D,取少量试剂分别进行实验得到如表格所示关系(其中无色气体能使澄清石灰水变浑浊,M溶液进行焰色反应为黄色)。
| A |
B |
C |
D |
|
| A |
白色沉淀X |
白色沉淀Y |
||
| B |
白色沉淀X |
无色气体 |
(1)写出试剂名称:A,B。
(2)写出生成X的离子方程式:。
(3)有人认为M是Na2CO3,此结论是否正确(填“正确”或“不正确”),如认为正确,请说明推断的依据,如不正确,请说明理由。
(4)若A、硝酸、D三种溶液混合后仍有沉淀,则其反应的离子方程式为。
浓硫酸具有以下A~F的性质:A酸性;B高沸点难挥发;C吸水性;D脱水性;E强氧化性;F溶于水放出大量热
(1)浓硫酸与铜共热发生反应的化学方程式为。实验中往往有大量蓝色固体析出,可见浓硫酸在该实验中表现的性质有。(浓硫酸性质用“A”、“B”、“C”、“D”、“E”、“F”填空,下同)
(2)实验证明铜不能在低温下与O2反应,也不能与稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并通入空气来制备CuSO4溶液。铜屑在此状态下被溶解的化学方程式为。硫酸在该反应中表现的性质是。
(3)在过氧化氢与稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式:。与(2)中反应比较,反应条件不同的原因是。
(4)向蔗糖晶体中滴2~3滴水,再滴入适量的浓硫酸。发现加水处立即变黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味的气体产生。写出产生有刺激气味气体的化学方程式:。该实验中浓硫酸表现的性质有。
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下图所示进行反应,又知E溶液是无色的。请回答:
(1)A是,B是,C是。(请填化学式)
(2)反应①的化学方程式为:。
(3)反应③的化学方程式为:。
(4)反应④的化学方程式为:。
A~G各物质间的关系如图,其中B、D为气态单质。
请回答下列问题。
(1)物质C和E的名称分别为、;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为;若只能在加热情况下进行,则反应物A应为;
(3)MnO2在反应①和反应②中的作用分别是、;
(4)新配制的F溶液应加入以防止其转化为G。检验G溶液中阳离子的常用试剂是,实验现象为。
氮化硅可用作高温陶瓷复合材料,在航空航天、汽车发动机、机械等领域有着广泛的应用。由石英砂合成氮化硅粉末的路线如下图所示:
其中-NH2中各元素的化合价与NH3相同。请回答下列问题:
(1)石英砂不能与碱性物质共同存放,以NaOH为例,用化学反应方程式表示其原因:。
(2)图示①~⑤的变化中,属于氧化还原反应的是。(3)SiCl4在潮湿的空气中剧烈水解,产生白雾,军事工业中用于制造烟雾剂。SiCl4水解的化学反应方程式为。
(4)在反应⑤中,3 mol Si(NH2)4,在高温下加热可得1 mol氮化硅粉末和8 mol A气体,则氮化硅的化学式为。
(5)在高温下将SiCl4在B和C两种气体的气氛中,也能反应生成氮化硅,B和C两种气体在一定条件下化合生成A。写出SiCl4与B和C两种气体反应的化学方程式。