(本体包括I、II两部分,共14分)
【I】工业上用CO2和NH3为原料合成尿素,尿素的化学式为CO(NH2)2。尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(III),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)C、N、O三种元素的第一电离能由大到小的顺序是 .
(2)尿素分子中C和N原子的杂化方式分别是 。
(3)NH4+中H—N—H键角比NH3中H—N—H键角大,原因为 .
【Ⅱ】在元素用期表中,某稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7。其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层层电子数为18.E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点量高。
(4))B元素在周期表中的位置 ;D元素的价电子排布式为 .
(5)已知B离子类似Cu2+与NH3形成配合离子,且两者配位数也相同,1mol该配离子中含有 molσ键。
(6)A元素可与E元素形成离子化合物,它的晶胞如图所示,E离子的配位数为 。每个A离子周围与之最近等距的A离子有 个.
(7)已知铜元素能形成多种化合物。
①CuSO4·5H2O也可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下图所示。下列说法正确的是 (填字母).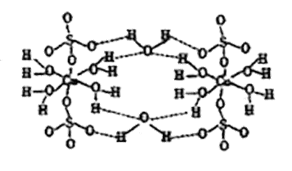
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.该晶体中电负性最大的元素是O
C.该晶体属于原子晶体
D.该晶体中的水在不同温度下会分步失去
②YBCD-12也是一种含Cu元素的化合物,化学式为YBa2Cu3O6.95。已知该化合物中各元素的化合价为:Y为+3价、Ba为+2价、O为—2价、Cu为+2价和+3价。则该化合物中+2价Cu和+3价Cu的原子个数之比为 .
氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。
(1)如图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是______ ________________。
________________。
(2).若由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436. 0kJ/mol,则N-H键的键能是________ kJ/mol。
如图是研究甲烷取代反应实验装置图,具体的实验方法是:
取一个100 mL的大量筒,用排饱和食盐水的方法先后收集20 mL CH4和80 mL Cl2,进行实验。
(1)若研究甲烷与氯气的取代反应,还需要的条件是________________________________。
(2)若将如图所示装置放在光亮的地方,等待片刻,观察到的现象是__________________。
(3)若将如图所示装置放在强光下照射会有_________________(填可能发生的不良后果)。
(4)写出甲烷和氯气的第一步反应方程式。
原子序数11—17的元素,自钠到氯,电子层数相同,最外层电子数从增加到,随着核电荷数依次递增,原子半径依次,核对外层电子的引力逐渐,失电子能力逐渐,得电子能力逐渐,因此,金属性逐渐,非金属性逐渐。
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A , C,D,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
。
(3)写出A、B两元素的最高价氧化物的水化物之间的相互反应的化学方程式:
。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
由铜、锌和稀硫酸组成的原电池中,正极是_______,发生______________,电极反应是________________;负极是_______,发生_____________,电极反应是_______,电子的流动方向是从极到极;电流方向是从极到极。