A、B、C、D、E、F是元素周期表中六种短周期元素,请根据表中信息回答下列问题
| 元素 |
A |
B |
C |
D |
E |
F |
| 性质或结构 信息 |
形成化合物种类最多的元素 |
最高正价是最低负价绝对值的3倍 |
族序数等于周期数的3倍 |
周期数是族序数的3倍 |
地壳中含量最高的金属元素 |
最高价氧化物对应水化物是最强的含氧酸 |
(1)元素B 的离子结构示意图 元素F的最高价氧化物的化学式为 。
(2)元素A、D分别与元素C 形成原子个数比为1:2的化合物甲和1:1 的化合物乙,则甲属于 分子(填“极性”或“非极性”),化合物乙的电子式 ,甲与乙反应的化学方程式为 。
(3)元素B、D组成化合物丙,其晶体类型为 ,化合物丙的溶液呈 (填“酸性”“碱性”或“中性”)。
(4)元素A与氢元素组成的最简单的化合物丁是一种优质燃料,燃烧热值高。
①实验测得,在常温常压下,1g化合物丁完全燃烧生成液态水,放出55.65 kJ 热量。则表示化合物丁的燃烧热的热化学方程式为 。
②某实验小组依据丁燃烧的反应原理,设计如右图所示的电池装置。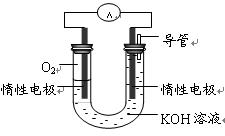
a.该电池正极的电极反应为 。
b.工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为 。
(5)G也是短周期元素,其核外电子层数与最外层电子数相等,且与E处于元素周期表中对角线位置,它们的单质及其化合物的性质相似,写出G的氧化物与NaOH溶液反应的离子方程式: 。若E的氯化物熔沸点较低、易升华,则E的氯化物是 化合物(填“离子”或“共价”),试设计一个简单实验证明你的选择 。
(1) 现有三份固体,分别是:
① 纯净的Na2CO3 a mol
② Na2CO3与NaHCO3的混合物共a mol
③ 纯净的NaHCO3 a mol
按要求回答下列问题:
a.分别与盐酸完全反应时,耗酸量从大到小的顺序为________________(填序号,下同)
b.分别和盐酸完全反应时,放出CO2气体的量的大小关系为____________
(2)若将上述(1)中的等物质的量改为等质量,再回答上述a、b两个问题。
a.分别与盐酸完全反应时,耗酸量从大到小的顺序为________________
b.分别和盐酸完全反应时,放出CO2气体的量的大小关系为____________
(3)若将a g Na2CO3和NaHCO3的混合物充分加热,其质量变为b g,则Na2CO3的质量分数为__________。
I. 书写下列反应的化学方程式
(1) 用FeCl3溶液作为腐蚀液刻制铜印刷电路板 ;
(2) 工业上粗硅的制取:
II. 与量有关的离子方程式书写
(1) Ba(OH)2溶液与NaHSO4溶液反应后溶液呈中性:
离子方程式 ;
(2) Ca(HCO3)2溶液与少量NaOH溶液反应
离子方程式 ;
(3) Al2(SO4)3溶液与过量NaOH溶液反应
离子方程式 ;
(学法题)书写此类离子方程式的关键是: 。
运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2═2N2+6H2O。电解质为KOH溶液,则负极反应式为______________________________。
(2)向BaCl2溶液中通CO2不会出现沉淀,因此某同学根据相同的理由认为向BaCl2溶液中通入SO2也不会出现沉淀,但在实验验证中发现了异常情况,将SO2通入BaCl2溶液中开始并无沉淀,放置一段时间出现了白色沉淀,则产生该沉淀的离子反应方程式为_ 。
(3)有人认为Mg、Si的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写):___________________。
关于平衡常数表达及影响因素的易混易错题组
运用化学反应原理研究碳、氮等单质及其化合物的反应有重要意义。
(1)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。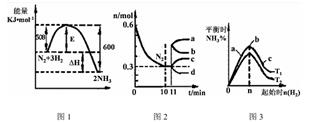
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2分析,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(2)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1∆H < 0(I)
NaNO3(s)+ClNO(g) K1∆H < 0(I)
2NO(g)+Cl2(g) 2ClNO(g) K2∆H < 0(II)
2ClNO(g) K2∆H < 0(II)
①4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
②为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。
(3)25℃时,反应2CO2(g) 2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。
2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。
回答下列问题:
(1)已知两种同素异形体A、B的燃烧热的热化学方程式为:
A(s)+O2(g)= CO2(g) △H=-393.51kJ/mol
B(s)+O2(g)= CO2(g) △H=-395.41kJ/mol
则两种同素异形体中较稳定的是(填“A”或“B”) 。
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol。该反应的热化学方程式是 。
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①2CH4(g)+O2(g) 2CO(g)+4H2(g);ΔH1="-72" kJ·mol-1
2CO(g)+4H2(g);ΔH1="-72" kJ·mol-1
②CH4(g)+H2O(g) CO(g)+3H2(g);ΔH2="+216" kJ·mol-1
CO(g)+3H2(g);ΔH2="+216" kJ·mol-1
氢气与氧气反应生成水蒸气的热化学方程式为 。
现有1 mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应。
若x=0.2时,反应①放出的能量为 kJ。
若x= 时,反应①与②放出(或吸收)的总能量为0。