工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
| |
Fe3+ |
Cu2+ |
Cr3+ |
| 开始沉淀pH |
2.1 |
4.7 |
4.3 |
| 完全沉淀pH |
3.2 |
6.7 |
a |

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到 ;②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
(4)当离子浓度≤1×10—5 mol•L-1认为沉淀完全,若要使Cr3+完全沉淀则要保持C(OH—)≥ 。已知:Ksp[Cr(OH)3]=6.3×10-31, )
)
(本题共12分)
l,6-己二酸(G)是合成尼龙(一种高分子合成纤维)的主要原料之一,可用含六个碳原子的有机化合物氧化制备。A通过氧化反应制备G的合成路线如下(可能的反应中间物质为B、C、D、E和F)。
完成下列填空:
46.化合物A中含碳87.8%,其余为氢,A的名称为___________________。
47.B到C的反应类型为______________。
48.F的结构简式为______________________________。
49.在上述中间物质中,不同环境氢原子最多的是_________,最少的是_________(填化合物代号)。
50.由G合成尼龙的化学方程式为_________________________________________________
51.写出由A通过两步反应制备1,3-环己二烯的合成路线。
(本题共10分)
化合物A有稳定性好、抗氧化能力强的特点,其结构如
分子中片段X对A的性能起了重要作用,为研究X的结构,将化合物A在一定条件下水解只得到B( )和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。
)和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。
完成下列填空:
42.化合物B能发生下列哪种类型的反应_________________
A.取代反应B.加成反应C.缩聚反应 D.氧化反应
43.化合物C能经下列反应得到G(分子式为C8H6O2,分子内含五元环)。
已知:
化合物C的结构简式为____________________________________。
44.反应F→G的化学方程式为___________________________________________________
45.化合物E有多种同分异构体,1H核磁共振谱图表明,其中某些同分异构体含有苯环,且苯环上有两种不同化学环境的氢,写出这些同分异构体中任意三种的结构简式是____________________
(本题14分)
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g) 2NH3(g)+Q(Q>0)
2NH3(g)+Q(Q>0)
一种工业合成氨的简易流程图如下:
完成下列填空:
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生。NH4HS的电子式是_______________,写出再生反应的化学方程式:_______________。NH3的沸点高于H2S,是因为NH3分子之间存在着一种比_________力更强的作用力。
29.室温下,0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是_______,其原因是_______。
已知:H2SO4:Ki2=1.2×10-2 NH3·H2O:Ki=1.8×10-5
30.图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______(答案用小数表示,保留3位有效数字)。
31.依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

32.上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法:________________________________。
(本题10分)
元素的单质及其化合物有着广泛的用途。请根据元素周期表中第三周期元素相关知识回答下列问题。
完成下列填空:
23.按原子序数递增的顺序(稀有气体除外),以下说法正确的是。
| A.原子半径和简单离子半径均减小 |
| B.金属性减弱,非金属性增强 |
| C.氧化物对应的水化物碱性减弱,酸性增强 |
| D.单质的熔点降低 |
24.原子最外层电子数与次外层中p亚层电子数相同的元素名称是__________,磷元素原子最外层电子排布的轨道表示式是________________________________。
25.已知:
| 化合物 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
| 类型 |
离子化合物 |
离子化合物 |
离子化合物 |
共价化合物 |
| 熔点/℃ |
2800 |
2050 |
714 |
191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_______________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是___________________________________。
26.晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:___________________________________。
27.KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式: _______________
下表为元素周期表的一部分,参照元素①~⑩在表中的位置,请用化学用语作答:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
⑤ |
||||
| 3 |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
(1)⑤、⑥、⑦的离子半径由大到小的顺序为。(填离子符号)
(2)⑧、⑨、⑩的最高价含氧酸的酸性由强到弱为。(用化学式表示)
(3)写出⑥在空气中加热生成的产物的电子式:。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。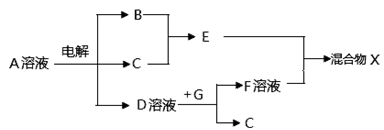
①写出D溶液与G反应的化学方程式。
②混合物X中的某物质不溶于水,但既能溶于酸又能溶于碱,请写出它在碱性溶液中的电离方程式。
(5)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式:。
(6)砷(As)的化合物可用于杀虫及医疗。
①As的原子结构示意图为。
②Y由④⑥⑩三种元素组成,是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为。