下表是A、B、C、D、E五种有机物的有关信息:
| A |
①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成C ③比例模型为:  |
| B |
①由C、H两种元素组成; ②球棍模型为:  |
| C |
①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯。 |
| D |
①相对分子质量比C少2; ②能由C氧化而成; |
| E |
①由C、H、O三种元素组成; ②球棍模型为: 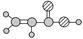 |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为___________;写出在一定条件下,A生成高分子化合物的化学方程式__________________。
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=___________时,这类有机物开始出现同分异构体。
(3)B具有的性质是________(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与KMnO4酸性溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式__________________。
(4)C与E反应能生成相对分子质量为100的酯,该反应类型为________;其化学方程式为____________。
(5)写出由C氧化生成D的化学方程式__________________。
在第3周期中,原子半径最大的金属元素是,(填元素符号,下同)离子半径最小的离子是,化学性质最稳定的元素是,最高价氧化物对应水化物的酸性最强的化合物的化学式是,最高价氧化物对应水化物的碱性最强的化合物的化学式是,显两性的氢氧化物的化学式是,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为、。
(1)H218O和D2O分子中的中子数,前者和后者的关系是(填序号,下同)
a.大于 b.小于 c.等于 d.无法确定
(2)化学变化中,可能发生改变的是
a.质子数b.中子数 c.核外电子数d.原子核
(3)右图为周期表的一部分,已知A,B,C,D,E五种元素,原子核外共有85个电子,E原子核外有四个电子层,B元素是
a.P b.Mg c.Cl d. Si
(14分)如图所示是电解氯化钠溶液(含酚酞)的装置。有毒气体收集的装置省略没有画出,两电极均是惰性电极。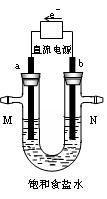
⑴a电极的名称, a电极的电极方程式为:____________.
⑵电解过程中观察到的现象。
⑶确定N出口的气体最简单的方法是,若收集N出口的气体体积在标准状况为1.12L,则电解过程中转移的电子数目为:_____________.
⑷电解的总反应离子方程式为。
⑸若将b电极换成铁作电极,写出在电解过程中U型管底部出现的现象_。
(9分)将铂丝插入稀硫酸溶液作电极,然后向两个电极上分别通入甲烷和氧气,可以形成原电池,由于发生的反应类似于甲烷的燃烧,所以称作燃料电池。根据两极上反应的实质判断,通入甲烷的一极为电池的___极,通入氧气的一极的电极反应式为_______________,该燃料电池放电一段时间后溶液的浓度将__________(选填“增大”,“减小”或“不变”)
(6分)一定温度下,向一固定容积的密闭容器中充入氢气和溴蒸气发生反应:H2(g)+Br2(g) 2HBr(g)。达到平衡状态后,下列说法中一定正确的是;能说明此反应达到平衡状态的是。
2HBr(g)。达到平衡状态后,下列说法中一定正确的是;能说明此反应达到平衡状态的是。
| A.单位时间内生成n mol H2的同时生成2n mol HBr |
| B.单位时间内生成n mol H2的同时生成n molBr2 |
| C.一个H-H键断裂的同时有两个H-Br键断裂 |
| D.[HBr]∶[H2]∶[Br2]=2∶2∶1 |
E.温度和体积一定时,某一生成物的浓度不再变化
F.温度和体积一定时,容器内压强不再变化