某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下: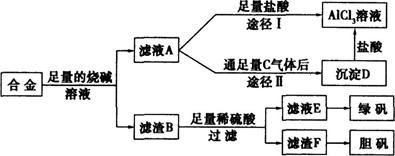
试回答下列问题:
(1)过滤用的器材已有:滤纸、铁架台、铁圈、烧杯和玻璃棒,还要补充的玻璃仪器是 。
(2)如何用实验证明沉淀D已洗涤干净 。
(3)由滤液A制得AlCl3溶液有途径I和Ⅱ两条,你认为合理的是途径 (填写“I”或“Ⅱ”),理由是 ;请写出途径Ⅱ得到沉淀D的离子方程式 。
(4)从滤液E中得到绿矾晶体的实验操作是蒸发浓缩、 、过滤。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,但前者的方案更合理,理由是 。
| A.后者消耗的酸和碱更多 | B.后者难以实现物质分离 |
| C.前者制得的产物更纯净 | D.前者操作步骤更少,方案简单 |
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→O2
⑴该反应中的还原剂是。
⑵该反应中,发生还原反应的过程是→。
⑶写出该反应的化学方程式,并标出电子转移的方向和数目。
⑷如反应转移了0.3mol电子,则产生的气体在标准状况下体积为。
(9分)取1.43g Na2CO3·XH2O 溶于水配成10mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0mL,并收集到112mL CO2(标况)。
求(1)稀盐酸物质的量浓度(2)Na2CO3·XH2O 的摩尔质量(3)x值_________
标准状况下,将X L HCl气体完全溶于1.00L水(密度为1.00g/cm3)中,得到质量分数为36.5%(密度为1.18g/cm3)的溶液,问:(计算结果保留到小数点后2位)
(1)X为。
(2)所得溶液的体积为L。
(3)所得溶液的物质的量浓度为。
海藻中提取碘的流程如图:
(1)指出提取碘的过程中有关实验操作名称:①__________,③________;写出过程②中有关反应的离子方程式_____________________________
(2)在提取碘的过程中,可供选择的有机试剂有下列四组,均可使用的是______ 。
| A.苯、酒精 | B.四氯化碳、苯 | C.汽油、醋酸 | D.汽油、氨水 |
(3)在3mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是
(注:下图片中深色区为紫红色溶液)
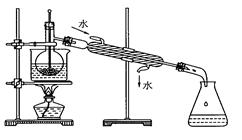
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持器、物品,尚缺少的玻璃仪器是_____________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图实验装置中的错误之处。
①____________ ;②_____________;③____________________。
现用Na2CO3固体配制500mL 0.200 mol•L-1的Na2CO3溶液。可供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤漏斗;⑥天平;⑦药匙。
请回答下列问题:
(1)上述仪器中,在配制Na2CO3溶液时不需要使用的有(填代号),还缺少的仪器是(填仪器名称)。
(2)经计算,需Na2CO3固体质量为。
(3)将所配制的Na2CO3溶液进行测定,发现浓度小于0.200 mol•L-1。请你分析配制过程中可能引起误差偏小的原因。
| A.定容时俯视液面 | B.转移时没有洗涤烧杯和玻璃棒 |
| C.配制时容量瓶没有干燥 | D.定容时仰视液面 |