X、Y、Z、W是元素周期表前四周中期中的四种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为3 4 4 |
⑴Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
⑵XY2是一种常用的溶剂,XY2的分子中存在 个 键。在H-Y、H-Z两种共价键中,键的极性较强的是 ,键长较长的是 。
键。在H-Y、H-Z两种共价键中,键的极性较强的是 ,键长较长的是 。
⑶W的基态原子核外电子排布式是 。W2Y在空中在空气中煅烧生成W2O的化学方程式是 。
⑷处理含XO、YO2烟道气 污染的一种方法,是将其在催化剂作用下转化为单质Y。
污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:
XO(g)+ 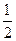 O2(g)====XO2(g) ΔH=-283kJ·mol-1
O2(g)====XO2(g) ΔH=-283kJ·mol-1
Y(s)+ O2(g)====YO2(g) ΔH=-296kJ· m
m ol-1
ol-1
此反应的热化学方程式是 。
铜在自然界存在于多种矿石中,如:
| 矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
| 主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S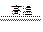 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请写出粗铜电解得到精铜的电极反应式:阳极 ;阴极。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
铜绿的主成分是碱酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ对;有 |
| B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ对;有 |
| C |
铁比铜活泼 |
例在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ对;有 |
| D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ对;无 |
下表列出了前20号元素中的某些元素性质的有关数据:
| ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
| 原子半径(10—10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
| 最高价态 |
+1 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
— |
| 最低价态 |
— |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是(写编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是、(写两种分子的分子式)。某元素R的原子半径为1.02×10—10m,该元素在周期表中的位置是;电解⑧和R的某种熔融化合物时,当阴极消耗 2 mol 该化合物的正离子时,阳极可得3 mol单质,。由此可推断得知该盐的化学式是(填化学式)。其阳极上所发生的电极方程式是:__________________________________。
已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题: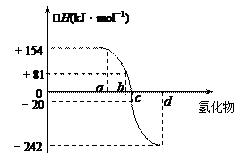
(1)写出氧族元素中含有18e-的两种氢化物的电子式、。
(2)请你归纳:非金属元素氢化物的稳定性与氢化物的生成热△H的关系
(3)写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:
肉桂酸甲酯(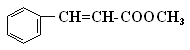 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
(1)肉桂酸甲酯的分子式是;
(2)有关肉桂酸甲酯的叙述中,正确的是(填标号);
| A.能与溴的四氯化碳溶液发生加成反应 | B.无法使酸性高锰酸钾溶液褪色 |
| C.在碱性条件下能发生水解反应 | D.不可能发生加聚反应 |
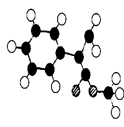 (3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如
(3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如
右图所示(图中球与球之间连线表示单键或双键)。G的
结构简式为;
(4)用芳香烃A为原料合成G的路线如下: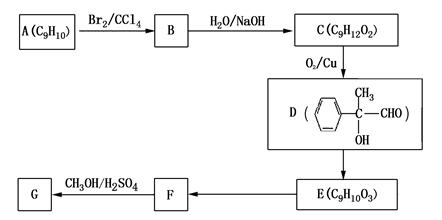
① 化合物E中的官能团有(填名称)。
② F→G的反应类型是,该反应的化学方程式为。
③ 写出符合下列条件的F的同分异构体的结构简式。
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.一定条件下,1mol该物质与足量银氨溶液充分反应,生成4mol银单质。
A、B、C、D、E为短周期元素,A~E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。试回答:
(1)B元素在周期表中的位置为___________________________________;
(2)将D的单质投入A2C中,反应后得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为__________________________________________。
(3)经测定,A2C2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___________________________________。过去常用硫酸处理BaO2来制备制备A2C2,写出该反应的离子方程式___________________________;
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡废印刷电路板既达到了上述目的,又保护了环境,试写出反应的离子方程式______________________________________。
(5)元素D的单质在一定条件下,能与A单质化合生成一种氢化物DA,熔点为800℃。
① DA能与水反应放氢气,反应化学方程式是。
②若将1mol DA和1 mol E单质混合加入足量的水,生成气体的体积是(标准状况下)L