四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| |
W |
X |
Y |
Z |
| 结构或性质 |
最高价氧化物是温室气体,其原子的最外层电子数是次外层电子数的2倍 |
最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 |
氧化物是常见的两性化合物 |
最高正价与最低负价之和为零 |
(1)Z的氧化物其主要用途为 。在自然界中是 的主要成分。
(2)①下列可作为比较X和W非金属性强弱的依据是 (填序号)。
a.自然界中的含量 b.氢化物的稳定性
c.最高氧化物水化物溶液的酸性 d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的非金属性强于W的原因:电子层数相同,核电荷数X大于W,原子半径X W,所以原子核对最外层电子的吸引力X W,得电子能力X大于W 。
(3)Y的氧化物与X的最高氧化物水化物溶液反应的离子方程式 。
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右(写出最佳答案)
(1)沉淀1的化学式是 ,试剂C的名称是 ,分离出沉淀2的操作名称是 ;
(2)写出混合液+A的离子方程式
生成沉淀2的离子方程式
①铁片;②饱和食盐水;③液态的纯硫酸(不含水);④蔗糖;⑤干冰;⑥熔融硝酸钾;⑦氢氧化钠固体。用序号回答:
(1)其中属于电解质的是 (填序号,下同),
(2)属于非电解质的是 ,
(3)可导电的是 。
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下: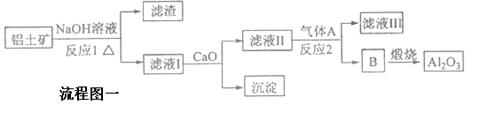
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
流程图二
回答下列问题:
(1)写出反应1的化学方程式___________________;____________________;
(2)若气体A过量,则反应2的离子方程式为 ;
(3)写出由D制备冰晶石的化学方程式 ___________________________;
(4)以石墨为阳极,电解氧化铝制铝时阳极的电极反应式_________________。
(1)镍氢碱性充电电池被誉为“绿色化学电源”,充、放电时的反应:
2Ni(OH)2 2NiO(OH) + H2放电时,正极的电极反应式为 ,充电时,该电极应与电源的 (填“正”或“负”)极相连。
2NiO(OH) + H2放电时,正极的电极反应式为 ,充电时,该电极应与电源的 (填“正”或“负”)极相连。
(2)氨在空气中燃烧,生成水和氮气。已知:N2(g)+3H2(g)  2NH3(g)△H= —92.4kJ·mol-1,2H2(g)+O2(g)
2NH3(g)△H= —92.4kJ·mol-1,2H2(g)+O2(g) 2H2O(l) ΔH="-572" kJ·mol-1,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为: 。
2H2O(l) ΔH="-572" kJ·mol-1,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为: 。
(3)研究表明工业上合成氨反应(N2(g)+3H2(g)  2NH3(g))在容积固定的密闭容器中发生上述反应,表一中为各物质在不同时刻的浓度。
2NH3(g))在容积固定的密闭容器中发生上述反应,表一中为各物质在不同时刻的浓度。
| 时间/min |
c(N2)/mol·L-1 |
c(H2) /mol·L-1 |
c(NH3) /mol·L-1 |
| 0 |
0.6 |
1.8 |
0 |
| 5 |
0.48 |
X |
0.24 |
| 10 |
0.26 |
0.78 |
0.68 |
表一
0~5 min,H2的平均反应速率vH2= 。反应在5分钟时,条件发生了改变,改变的条件可能是 (填序号)。
a.增加氢气的浓度b.降低温度 c.使用催化剂 d.分离出NH3
已知A、B、C、D、E、F都是短周期的主族元素,原子序数依次增大,其中A是宇宙中最丰富的元素,B的单质常温下为气体,C和E同主族,C和E可形成EC2和EC3两种分子,D是短周期中原子半径最大的元素。请回答下列问题:
(1)①B在元素周期表中的位置________________________;
②上述元素的最高价氧化物的水化物中酸性最强的酸是________(写化学式)。
(2)C、D、E、F四种元素对应的简单离子的半径由小到大的顺序是_____(用离子符号表示)。
(3)工业上常用A、B组成的物质X来检验F的单质是否发生泄漏,有大量白烟生成,写出此反应的化学方程式______________________。其中该反应中还原剂和氧化剂的物质的量之比为_______________.