“氢能”将是未来最理想的新能源。
Ⅰ.实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为_______。(填序号)
A.2H2(g)+O2(g)  2H2O(l)△H= -142.9kJ·mol—1 2H2O(l)△H= -142.9kJ·mol—1 |
B.H2(g)+1/2 O2(g)  H2O(l)△H= -285.8kJ·mol—1 H2O(l)△H= -285.8kJ·mol—1 |
C.2H2+O2 2H2O(l)△H= -571.6kJ·mol—1 2H2O(l)△H= -571.6kJ·mol—1 |
D.H2(g)+1/2 O2(g)  H2O(g) △H= -285.8kJ·mol—1 H2O(g) △H= -285.8kJ·mol—1 |
Ⅱ.某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg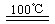 HgBr2+H2
HgBr2+H2
③HgBr2+_____ ______________ ④2HgO
______________ ④2HgO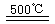 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:____________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:______________。
Ⅲ.利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O2、SO2和H2O)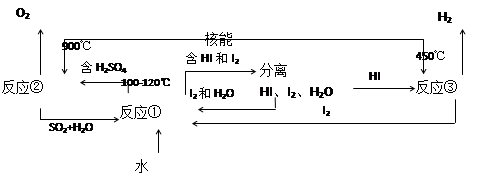
完成下列反应的化学方程式:
反应①__________________________;反应②__________________________。
此法制取氢气的最大优点是_______________________________________________。
Ⅳ.氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) 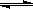 CO2(g)+ H2(g); △H<0。
CO2(g)+ H2(g); △H<0。
在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2和 x mol H2,则:
①当x=5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“大于”、“小于”或“等于”)。
Ⅴ.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是 ;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体 g;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是 ,其物质的量之比是 ;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68g。经分析,原溶液中的Cu2+有20%残留在母液中。求所得晶体的化学式
有一固体混合物可能含有氯化铁、亚硝酸钠、硝酸银、氯化铜、硝酸钠、熟石灰和氯化铵等7种物质。将混合物溶于水得白色沉淀和无色溶液。白色沉淀可溶于氨水中。无色溶液与强碱共热放出的气体可使酚酞变红。无色溶液也可使酸性高锰酸钾溶液褪色。无色溶液受热时可放出氮气。
已知:Ksp(AgNO2)=6.0×10-4;Ksp(AgCl)=1.56×10-10
回答下列问题(用化学符号回答):
(1)该固体混合物中肯定存在的物质是________________,肯定不存在的物质是_______________。
(2)混合物溶于水时所得的白色沉淀中肯定有________________。该沉淀溶于氨水的离子方程式为_______________________________________。
(3)无色溶液中,使酸性高锰酸钾褪色的物质是___________________。
(4)写出无色溶液受热时放出氮气的化学方程式__________________。
向含0.2molAl3+的明矾溶液中逐渐加入2mol/LBa(OH)2溶液时,测得产生沉淀质量m(g)和逐渐加的2mol/LBa(OH)2溶液的体积(mL)的关系如下图,试填写空白
(1)写出OA段反应的离子方程式
OA;
(2)m1 = V1 =
m2 =V2=
图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。试回答下列问题:
(1)Z→L反应的名称是。
(2)K的电子式为。
(3)写出B→F的离子方程式。
(4)写出K与CO2反应的化学方程式。
(5)Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出该反应的离子方程式。
已知硝酸与金属发生氧化还原反应的时候,一般硝酸浓度越稀,对应的还原产物中氮的化合价越低。现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示。则:
(1)试写出DE段、EF段所发生反应的离子方 程式:
程式:
DE段
EF段
(2)合金中铝的物质的量为mol
(3)合金中金属的物质的量共为mol
(4)求出C点的值为ml
汽车安全气囊 是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。
是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。 单质乙就在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
单质乙就在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲的化学式为,丙的电子式为。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为。
(3)单质乙与红棕色粉末发生反应的化学方程式为,安全气囊中红棕色粉末的作用是。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是。
| A.KCl | B. KNO3 KNO3 |
C.Na2S | D.CuO |