(本题共15分)
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下: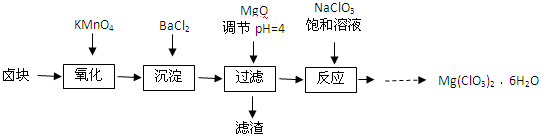
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②Mg(ClO3)2、NaClO3 、MgCl2 、NaCl 四种
化合物的溶解度(S)随温度(T)变化曲线如图所示。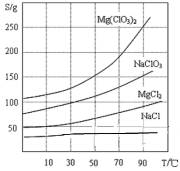
(1)加速卤块在KMnO4溶液中溶解的措施有: (写出一点即可)。
(2)加入MgO的作用是 ;过滤后所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制 Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;② ;③ ;④过滤洗涤。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.0 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热,将Fe2+氧化成Fe3+。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7 溶液滴定剩余的Fe2+至终点。
此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次
(4)①写出步骤2中发生反应的离子方程式: ;
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果 (填“偏大”、 “偏小”或“不变”);
(5)若平均消耗K2Cr2O7 溶液15.00 mL,则产品中Mg(ClO3)2·6H2O的质量分数为 。
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈______(填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+)_____c(CH3COO-)(填“>”“<”或“=”,下同)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈,溶液中c(Na+)_____c(CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈______,醋酸体积______氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则原醋酸溶液中c(H+)______氢氧化钠溶液中c(OH-),m与n的大小关系是m______n。
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下反应:
(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g)(I)
(1)反应(I)中氧化剂是__________。
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g) 2NO2(g)(II)当温度升高时,气体颜色变深,则反应(II)为________(填“吸热”或“放热”)反应。
2NO2(g)(II)当温度升高时,气体颜色变深,则反应(II)为________(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1molN2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是_______;
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数______(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)= ______mol•L-1•s-1。
已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题:
(1)各装置名称是:A池____________;C池____________;
(2)写出电极上发生的反应:②____________;⑥____________;
(3)当电路上有1mol电子流过时,①极上质量变化___________;⑥极上质量变化___________;
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3的化学反应方程式_____________________________
(2)已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O=Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是____________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3―→Se+I2+KNO3+H2O
②I2+2Na2S2O3=Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目___________________________
(4)实验中,准确称量SeO2样品0.150 0 g,消耗0.200 0 mol·L-1的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为________。
将一定质量的镁铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。
(1)加入NaOH 0~ 20mL 时发生反应离子方程式___________________,
加入NaOH 20~ 200mL 时发生反应离子方程式___________________,
加入NaOH 200~ 240mL 时发生反应离子方程式___________________,
(2)镁和铝的总质量为________g
(3)硫酸的物质的量浓度为___________ mol/L
(4)生成的氢气在标准状况下的体积为__________L