工业上,将黄铜矿(CuFeS2)通过8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
(1)上述反应中,还原剂为 。
(2)黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.通过上述②,炉渣中的Al2O3变成了 (写离子)。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 酸性KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
(3)对上述炉渣中进行含铁量的测定步骤如下: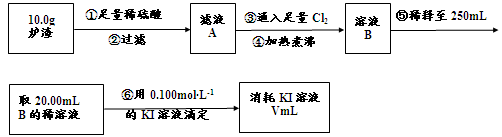
I.步骤③发生反应的离子方程式为 。
II.步骤④中煮沸的作用是 。
III.步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
IV.若滴定过程中消耗0.100mol·L−1KI溶液20.00mL,则炉渣中铁的百分含量为 。
选择下列实验方法分离物质,将分离方法的序号填在横线上
A 萃取分液法 B 结晶法 C 分液法 D 蒸馏法 E 过滤法
①__ ___分离饱和食盐水与沙子的混合物。
②___ _分离水和汽油的混合物。
③____ __分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
④___ __从碘的水溶液里提取碘。
⑤____ __从硝酸钾和氯化钠的混合液中获得硝酸钾。
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。将它们分别与H2SO4作用,A产生白色沉淀,B产生无色气体,C中无明显现象。则A是____ ____,B是____ ____, C是_____ ___。
含Al3+5.4g的硫酸铝的物质的量为 ,其中含SO42- 个。
某二价金属1.6g在氧气中完全燃烧生成2g氧化物,则该金属的相对原子量 。
3.12克Na2X中含有0.08molNa+,则Na2X的摩尔质量是 。