(15分)含铬污水处理是污染治理的重要课题。污水中铬元素以Cr2O72-和CrO42-形式存在,常见除铬基本步骤是:
(1)加酸可以使CrO42-转化为Cr2O72-: 2CrO42- + 2H+ Cr2O72- + H2O
Cr2O72- + H2O
若常温下pH=1溶液中Cr2O72-浓度为0.1 mol•L-1,Cr2O72-浓度是CrO42-浓度的10倍,该化学平衡常数K= 。
(2)六价铬的毒性大约是三价铬的100倍,二氧化硫还原法是在酸性溶液中通SO2将Cr2O72-还原,反应的离子方程式为 。而后再加碱将Cr3+沉淀,已知常温下Ksp[Cr(OH)3] =10-32,要使c(Cr3+)降低到10-5mol•L-1,溶液的pH应升高到 。
(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片连接直流电源的 极。
(4)Cr(OH)3为绿色粘性沉淀,类似于Al(OH)3既溶于酸又能溶于强碱溶液。Cr(OH)3溶于稀硫酸的化学方程式为 。往100.00mL 0.1000 mol•L-1CrCl3溶液滴加1.000mol•L-1NaOH溶液, 请画出生成沉淀的物质的量与加入NaOH溶液体积的关系图:
【化学—选修2:化学与技术】南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水。
(1)硬水是指含有较多______________的水,硬水加热后产生沉淀的离子方程式为:_____________(写出生成一种沉淀物的即可)。
(2)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO),已知水的硬度在8°以下的软水,在8°以上的称为硬水。已知岛上山泉水中c( Ca2+)=1.2×10-3 mol/L,c(Mg2+) =6×l0-4 mol/L,那么此水 (填“是”或“否”)属于硬水。
(3)离子交换法是软化水的常用方法。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 。
(4)解放军战士通常向水中加入明矾净水,请用离子方程式解释其净水原理: 。
(5)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题: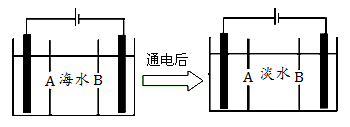
①阳离子交换膜是指 (填A或B)。
②写出通电后阳极区的电极反应式 ,阴极区的现象是: 。
利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
(1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g) N2O3(g),其平衡常数表达式为K=
N2O3(g),其平衡常数表达式为K=
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是 ;滤渣可循环利用,滤渣的主要成分是 (填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1:1,写出该工艺的化学反应方程式 ;若n(NO) :n(NO2)>1:1,则会导致 ;若n(NO) :n(NO2)<1:1,则会导致 。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式 。
铁及其化合物在日常生活、生产中应用广泛。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,工业上利用NaClO 和NaOH的混合溶液将2Fe(OH)3氧化性制备高铁酸钠,反应的化学方程式为 ;高铁酸钠能用作新型净水剂的原理是 ;
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
①酸溶过程中发生反应的化学方程式为 , , ;“滤渣A”主要成份的化学式为 。
②还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请写出该反应的离子方程式 ;
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是 ,
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.8 |
7.6 |
9.4 |
| 完全沉淀pH |
3.2 |
5.2 |
9.7 |
12.4 |
如果pH过大,可能引起的后果是 。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1 <0(I)
NaNO3(s)+ClNO(g) K1 ΔH1 <0(I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2 <0(II)
2ClNO(g) K2 ΔH2 <0(II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
(用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应(II)达到平衡。
测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
进入秋冬季节后,郑州市频现雾霾天气,给人们的出行带来极大的不便和危害,人们“谈霾色变”。目前郑州市汽车保有量达230万量,汽车尾气的污染是引起雾霾的主要因素之一,NO和CO是汽车尾气的主要污染物。
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)  SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
(2)某科研机构设计传感器检测CO的含量,其工作原理示意图如下:
Pt电极上发生的是 反应(填“氧化”或“还原”);写出NiO电极的电极反应式
(3)在汽车尾气系统中安装催化转化器可减少CO和NO的污染,用化学方程式表示其原理