羰基化反应是制备不饱和酯的有效途径,如:
反应①:
化合物I可由化合物Ⅲ合成:
(1)化合物Ⅱ的分子式为________,化合物Ⅱ在NaOH溶液中完全水解的化学方程式为_________。
(2)化合物Ⅲ的结构简式为________,化合物Ⅳ通过消去反应生成化合物I的化学方程式为______(注明反应条件)。
(3)化合物Ⅴ是化合物Ⅱ的同分异构体,苯环上有两个取代基且能发生银镜反应,Ⅴ的核磁共振氢谱除苯环峰外还有两组峰,峰面积之比为1︰2,Ⅴ的结构简式为_________(写一种即可)。
(4)聚合物 单体的结构简式为_________。用类似反应①的方法,利用丙炔与合适的原料可以合成该单体,化学方程式为________。
单体的结构简式为_________。用类似反应①的方法,利用丙炔与合适的原料可以合成该单体,化学方程式为________。
T℃时,pH = 2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示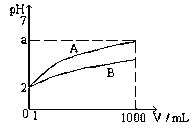
(1)图中a点的值为
(2)若对上述硫酸再稀释10000倍则溶液中n (H+) :n(SO42-)=
(3)在T℃时,醋酸的电离平衡常数K=1.0×10-5, Kw=1.0×10-13则下列反应CH3COO-+H2O CH3COOH+OH-的平衡常数K= 。
CH3COOH+OH-的平衡常数K= 。
(4)在T℃时,取pH=2的硫酸溶液0.5Vml稀释到2Vml ,与0.1mol/L的NaOH溶液0.15Vml混合后稀释至10Vml,溶液的pH= 。
已知体积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),请根据化学反应的有关原理回答下列问题:
2SO3(g),请根据化学反应的有关原理回答下列问题:
(1)一定条件下,充入2.0 mol SO2 (g) 和1.0 mol O2(g),20 s后达平衡,测得SO3的体积分数为50%,则用SO2表示该反应在这20 s内的反应速率为 mol/(L·s)。
(2)该反应的平衡常数K= ,若降温其值增大,则该反应的ΔH 0(填“>”或“<”或“=”)。
(3)如图,P是可自由平行滑动的活塞,在相同温度时,向A容器中充入4 mol SO3(g),关闭K,向B容器中充入2 mol SO3(g),两容器内分别充分发生反应。已知起始时容器A和B的体积均为a L。试回答:反应达到平衡时容器B的体积为1.25 a L,若打开K,一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(4)如图表示该反应的速率(v)随时间(t)的变化的关系:据图分析:你认为t1时改变的外界条件可能是________ ;t6时保持压强不变向体系中充入少量He气,平衡_ ____移动。(填“向左”“向右”或“不”)。
某温度下,容积同为2L的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知某温度下2HI(g)  H2 (g)+I2 (g)ΔH =+AkJ·mol-1 K=4.0)
H2 (g)+I2 (g)ΔH =+AkJ·mol-1 K=4.0)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
2 mol HI |
1 mol H2+1 mol I2 |
2 mol HI+1 mol H2 +1 mol I2 |
| HI的浓度 |
c1 |
c2 |
c3 |
| 反应的能量变化 |
吸收akJ |
放出bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
a1 |
a2 |
a3 |
(1)根据上表回答问题
①c1、c3的关系式为 ;②a、b的关系式为 ;
③p2、p3的关系式为 ;④a1与a2的关系式为 ;
(2)甲容器中:该反应的平衡常数表达式为 。
(3)乙容器中:反应在开始2分钟后达平衡状态,则该反应在这2分钟内用HI表示的平均反应速率为 mol·L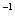 ·min
·min
(4)丙容器中:反应开始时V正 V逆(填“小于”、“等于”或“大于”)
工业常用燃料与水蒸气反应制各H2和CO,再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.4kJ·mol-1,下列判断正确的是_______。
CO(g)+H2(g) △H=+131.4kJ·mol-1,下列判断正确的是_______。
A.该反应的反应物总能量小于生成物总能量
B.标准状况下,上述反应生成IL H2气体时吸收131.4kJ的热量
C.若CO(g)+H2(g)  C(s)+H2O(l) △H=-QkJ·mol-1,则Q<131.4
C(s)+H2O(l) △H=-QkJ·mol-1,则Q<131.4
D.若C(s)+CO2(g)  2CO(g) △H1;CO(g)+H2O(g)
2CO(g) △H1;CO(g)+H2O(g)  H2(g)+CO2(g) △H2则:△H1+△H2="+131.4" kJ·mol-1
H2(g)+CO2(g) △H2则:△H1+△H2="+131.4" kJ·mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO.该反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
己知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| 不同时间各物质的物质的量/mol |
||||
| 0min |
2min |
4min |
6min |
|
| CH4 |
2.00 |
1.76 |
1.60 |
n2 |
| H2 |
0.00 |
0.72 |
n1 |
1.20 |
根据表中数据计算:
①0min~2min内H2的平均反应速率为_______。
②达平衡时,CH4的转化率为________。在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比______(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有______(填字母)
A.CO的含量保持不变
B.容器中c(CH4)与c(CO)相等
C.容器中混合气体的密度保持不变
D.3v正(CH4)=v逆(H2)
( 3 )合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如下图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过)。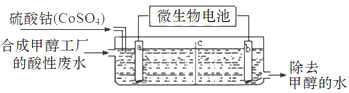
①a电极的名称为________。
②写出除去甲醇的离子方程式____________
石油是一种极其重要的资源,是发展国民经济和国防建设重要物资。B的产量通常用来衡量一个国家的石油化工水平,A是生活中常见的有机物,易溶于水并有特殊香味。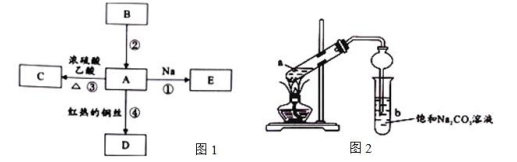
Ⅰ.有关物质转化关系如图1所示:
(1)足量烃B通入溴水的实验现象是 。
(2)反应②属于 反应(填有机反应类型)。
(3)写出反应④的化学方程式 。
Ⅱ.某化学兴趣小组对反应③进行探究活动,设计如图2装置进行实验:
(4)在实验中球形干燥管除起冷凝外,另一个重要作用是 。
(5)反应结束后b中的现象是 。