(14分)工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键的步骤。
(1)一定条件下,SO2可发生反应:SO2(g)+ O2(g)
O2(g) SO3(g) △H=﹣98kJ·mol﹣1。
SO3(g) △H=﹣98kJ·mol﹣1。
①某温度下,在100 L的恒容密闭容器中开始加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=_______(用分数表示)。
②上述反应按照相同的物质的量投料,测得SO2在不同温度下的平衡转化率a%与压强的关系如下图所示。下列说法正确的是_______(填序号)。
| A.温度:T3>T2>T1 |
| B.正反应速率:v(c)>v(a),v(b)>v(d) |
| C.平衡常数:K(a)>k(c),K(b)=K(d) |
| D.平均摩尔质量:M(a)>M(c),M(b)>M(d) |
③上述反应达平衡后,保持温度和容器的压强不变,若再通入一定量SO3(g),则SO2的体积分数_______(填“增大”、“减小”、“不变”)。
(2)某人设想以下图所示装置用电化学原理模拟生产硫酸:
①通入O2的电极是________极。
②写出通入SO2的电极的电极反应式:_______________
③若此过程中转移了0.2mol电子,则质子膜两侧电解液的质量变化差(△m左﹣△m右)为________g(忽略气体的溶解)。
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;
②X分别与Y、Z、W可组成化学式为YX3,X2Z和X2W三种共价化合物
请填空:
(1)X、Y、Z原子最外层电子数之和是________
(2)X2W的结构式是________
(3)X、Y和Z组成的一种化合物是强酸.写出该酸的稀溶液与铜反应的离子方程式:
________________________________________________________________________
含Y、Z的气体和一种只含X、Z的液体(在常温、常压下)反应可以生成一种离子化合物其化学式为________
(4)X、Y、Z和W组成一种化合物,其原子个数之比为5∶1∶3∶1;该化合物具有
还原性。
① 写出该化合物与过量稀NaOH溶液反应的离子方程式:
________________________________________________________________________.
② 请设计实验证明该化合物具有还原性:
________________________________________________________________________。
浓硫酸在实验室可用来干燥Cl2、HCl等气体,这是利用了浓硫酸的__________性。 蔗糖遇浓硫酸变黑,是由于浓硫酸具有__________性。若将盛有浓硫酸的容器敞口放在空气中一段时间后, 其质量会__________(填“增加”、“减少”或“没有变化”)。
已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。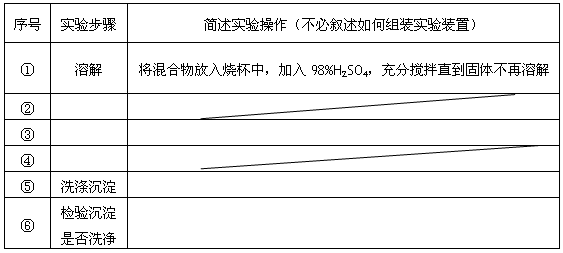
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入0.5 L密闭容器内,550℃时,在催化剂作用下发生反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热)。测得n(O2)随时间的变化如下表
2SO3(g)(正反应放热)。测得n(O2)随时间的变化如下表
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(O2)/mol |
0.7 |
0.4 |
0.3 |
x |
x |
x |
反应达到5s后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了22.4L(此体积为标准状况下的体积);再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(此体积为标准状况下的体积)。
请回答下列问题:
(1)用O2表示从0~1s内该反应的平均反应速率为;
(2)O2的平衡浓度c(O2)=;
(3)4s时,SO2的生成速率____________(填“大于”、“小于”或“等于”)O2的消耗速率。
(4)求该反应达到平衡时SO2的转化率是____________(用百分数表示)。
(5)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀____________克(计算结果保留一位小数)。
有A、B、C、D、E、F、G、H、I九种常见物质,它们的转化关系(反应条件未注明)如图所示。常温下A为液态,D为固态,B、C、E、G为气态(C可以使带火星木条复燃),其中B、C、D为单质,F为淡黄色粉末状化合物,I的焰色反应为黄色。
请回答:(1)写出F的电子式。(2)G的结构式是。
(3)反应④是反应(填“吸热”或者“放热”)
(4)写出反应⑤的化学反应方程式
(5)B、C单质已被应用于字宙飞船的燃料电池中,如图所示。若将B换成甲烷也能组成燃料电池(两个电极均由多孔性碳构成),该电池工作时:
①b电极附近溶液的pH将(填“增大”“减小”“不变”);
②a电极上的电极反应式为:。
(6)在标准状况下,若将3.36L气体G通入50mL 4mol/L的H溶液中,用一个离子方程式表示其过程: