按要求完成下列各小题。
(1)甲中显酸性的官能团是 (填名称)。
(2)下列关于乙的说法正确的是 (填序号)。
a.分子中碳原子与氮原子的个数比是7 : 5
b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应
d.属于苯酚的同系物
(3)写出丙物质与足量NaOH溶液共热的化学方程式 。
(4)已知以下信息:

1molB经上述反应可生成2molC,且C不能发生银镜反应。
则由A生成B的化学方程式为
(5) 的一种同分异构体满足下列条件:
的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式: 。
(6)已知有下列反应:
试写出只用1,3-丁二烯合成六元环化合物的结构简式 。
(1)用系统命名法命名烃A:_______________________________;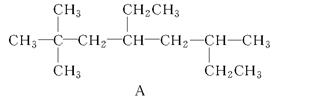
烃A的一氯代物具有不同沸点的产物有________种。
(2)有机物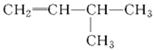 的系统名称是,将其在催化剂存在下完全氢化,所得烷烃的系统名称是。
的系统名称是,将其在催化剂存在下完全氢化,所得烷烃的系统名称是。
(3)有机物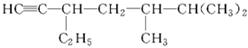 的系统名称是,将其在催化剂存在下完全氢化,所得烷烃的系统名称是。
的系统名称是,将其在催化剂存在下完全氢化,所得烷烃的系统名称是。
如图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。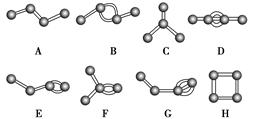
(1)图中属于烷烃的是________(填字母)。
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成________和________;不仅可以形成________,还可以形成碳环。
(3)上图中互为同分异构体的是:A与_____________________。B与________;D与________(填字母)。
有9种微粒:①NH2-;②—NH2;③Br-;④OH-;⑤—NO2;⑥—OH;⑦NO2;⑧CH3+;⑨—CH3。
(1)上述9种微粒中,属于官能团的有(填序号)________。
(2)其中能跟—C2H5结合生成有机物分子的微粒有(填序号)________。
(3)其中能跟C2H5+结合生成有机物分子的微粒有(填序号)________。
请根据官能团的不同对下列有机物进行分类。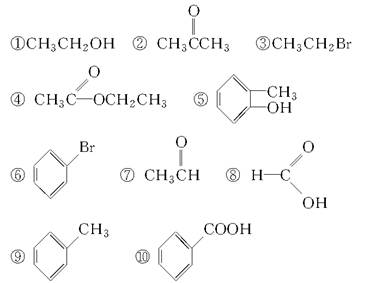
(1)芳香烃:______;(2)卤代烃:______;
(3)醇:______;(4)酚:________;(5)醛:________;
(6)酮:____________;(7)羧酸:____________;
(8)酯:______________。
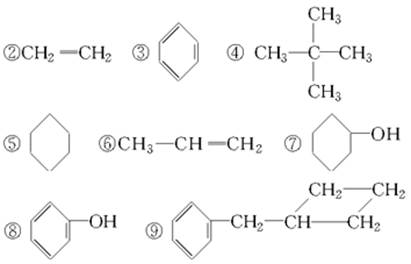
在下列化合物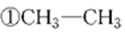
 中
中
(1)属于环状化合物的有________,
(2)属于脂环化合物的有________,
(3)属于芳香化合物的有________,
(4)属于脂肪烃的有________。