水煤气转化反应CO(g)+H2O(g)  CO2(g)+H2 (g)在一定温度下达到化学平衡状态。
CO2(g)+H2 (g)在一定温度下达到化学平衡状态。
完成下列填空:
(1)写出该反应的平衡常数表达式K=________________。
(2)一定温度下,在一个容积不变的密闭容器中发生上述反应,下列说法中能判断该反应达到化学平衡状态的是 (选填编号)。
a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 molH-O键
c.v正(CO) = v逆(H2O) d.c(CO) = c(H2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下实验组1和实验组2的数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
3 |
| 2 |
650 |
1 |
2 |
0.8 |
1.2 |
5 |
| 3 |
950 |
1 |
2 |
— |
— |
— |
①由实验组1的数据可知,平衡时CO的转化率为 %。
②由实验组1和2的数据可分析,压强对该可逆反应的影响是 。
③有了实验组1和2的数据,再设计实验组3,其目的是 。
对于可逆反应:N2 (g)+3H2(g) 2NH3(g)能量变化如右图,回答下列问题:
2NH3(g)能量变化如右图,回答下列问题: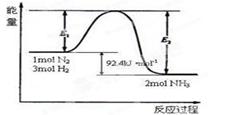
(1)在反应体系中加入催化剂,反应速率增大,E2和△H的变化是:E2 ,△H (填“增大”、“减小”、“不变”)
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量 (填“<”、“>”或“=”)46.2kJ。
(3)关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S< 0 C.△H<0,△S>0 D.△H<0,△S<0
(4)将一定量的N2和H2放入 1L密闭容器中,在500℃、2×107Pa下达到平衡,欲提高合
成氨中H2的转化率,下列措施可行的是 (填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨
(5)在一定温度、压强和有催化剂存在的条件下将1 mol N2和2.5 mol H2 放入500ml密闭容器中,经过20min达到平衡,平衡后NH3的浓度为2mol/L,则用N2表示20min内的平均反应速率为:_____________,该温度下此反应的平衡常数K=___________,H2的转化率为____________。如果保持温度不变,再向容器中同时充入1.5mol N2和1mol NH3,H2的转化率将______________(填“升高”、“不变”或“降低”)。
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是(填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,
测得c(CO)= 0.2 mol/L,则CO的转化率为,此时的温度为(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)
ΔH1= -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池负极的电极反应式为。
② 工作一段时间后,测得溶液的pH将(填“增大”、“减小”、“不变”)。 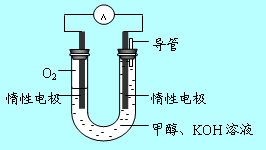
根据下列框图关系填空。已知常温下X为无色液体,D、E均为无色气体,
G是一种重要的工业产品。C的焰色反应为黄色,E、F的相对分子量之间的关系为
M(F)=M(E)+16。回答下列问题: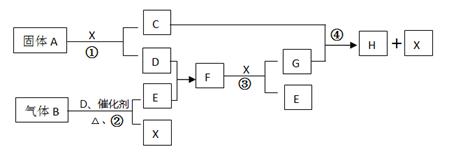
(1)A中化学键的类型为,写出B的一个用途。
(2)将固体A加入FeCl3溶液中的主要现象是。
(3)写出气体B的水溶液与CuSO4溶液反应的离子方程式。
(4)写出反应②的化学方程式。
(5)经测定,反应④中每生成1.0gX,放出3.2KJ的热量(常温下)。试写出反应④
的热化学方程式。
已知:①A是石油裂解气里的主要气体
(1)写出A物质的名称;D物质的结构简式。
(2)写出反应②的类型;反应⑥的类型。
(3)写出反应⑤ 的化学方程式:。
的化学方程式:。
(4)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出
它的结构简式:
(5)分子中具有苯环,苯环上含有两个取代基,且能与NaHCO3溶液反应的E的同分异构体有种(不包含E)。
请根据右图装置,回答相关问题:
(1)C池属于什么装置______。
(2)写出电极上发生的反应:②_____________,③___________。
(3)反应进行一段时间后,A、B、C三池中电解质溶液浓度基本不变的是________。
(4)当电路上有0.2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。