甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”)。
② 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,
测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)
ΔH1= -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池负极的电极反应式为 。
② 工作一段时间后,测得溶液的pH将 (填“增大”、“减小”、“不变”)。 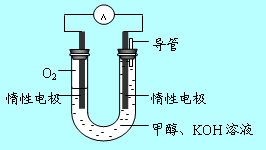
回答下列问题:
(1)将SO2和Cl2分别通入装有品红溶液的两个试管中,两溶液的红色均褪去。加热后,有一支试管中的溶液又呈现红色,该试管通入的气体是,该实验说明的问题是。
(2)将SO2和Cl2按1:1体积比(同温同压)混合后通入品红溶液中,溶液不褪色。为检验两种气体在溶液中是否发生了氧化还原反应,应向所得溶液加入的试剂是(填化学式)。经实验证明,SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是。
(8分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是
(2)X与W组成的化合物中存在键(填“离子”“共价”)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
。
(15分)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
| 阳离子 |
K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 |
Cl-CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为
_______________________________________________________________
(4)甲同学最终确定原溶液中所含阳离子是,阴离子是。(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为g。
(6)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是
| 选项 |
污染物 |
处理措施 |
方法类别 |
| A |
废酸 |
加生石灰中和 |
物理法 |
| B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
| C |
含复杂有机物的废水 |
通过微生物代谢 |
物理法 |
| D |
碱性的废水 |
用CO2来中和 |
化学法 |
A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表。Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子。
| A |
B |
D |
E |
|
| 化合价 |
-4 |
-2 |
-3 |
-2 |
| 电负性 |
2.5 |
2.5 |
3.0 |
3.5 |
(1)基态Fe原子的电子排布式为。
(2)Fe、Co两元素的第三电离能I3(Fe)I3(Co)(填“<”或“>”)。
(3)B、D、E的气态氢化物的沸点由高到低的顺序为(填化学式)。
(4)Co与E形成的化合物晶胞如右图所示,则该化合物的化学式为。(用元素符号表示)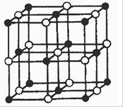
(5)Co的离子能与AD-离子生成各种配合物。紫色的配离子[Co(AD)6]4-是一种相当强的还原剂,在加热时能与水反应生成[Co(AD)6]3-。
①HAD分子中A元素的杂化类型为,D元素的化合价为。
②写出[Co(AD)6]4-在加热时与水反应生成[Co(AD)6]3-的离子方程式:。
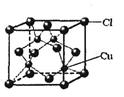
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):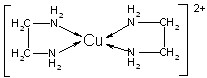
请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为,
H、N、O三种元素的电负性由大到小的顺序是;
(2)SO2分子的空间构型为;
(3)乙二胺分子中氮原子轨道的杂化类型为,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是。
(4)配离子[Cu(En)2]2+的配位数为,该微粒含有的微粒间的作用力类型有(填字母);
| A.配位键 | B.极性键 | C.离子键 | D.非极性键 |
E.氢键 F.金属键
(5)CuCl的晶胞结构如右图所示,其中Cl-的配位数(即与Cl-最近距离的Cu+的个数)为。