(15分).钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。工业上常以钛矿石(主要成分为FeTiO3(钛酸亚铁),并含FeO、A12O3、 SiO2等杂质)为主要原料经过以下流程制得TiO2,并获得副产品FeSO4·7H2O.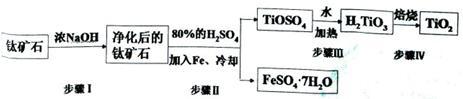
请回答下列问题:
(l)步骤I的目的是
(2)写出步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式 。
(3)步骤II中经过 、 、过滤、洗涤等操作可以得到FeSO4·7H2O.晶体,还可以利用酸化的FeSO4溶液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水).该反应的离子方程式为
(4)请结合化学用语用化学平衡理论解释步骤III中将TiOSO4转化为H2TiO3的原理:
(5)为测定步骤II后溶液中TiOSO4的含量,首先取待测钛液10 mL加水稀释至100 mL,再加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,以KSCN溶液为指示剂,用0.1000 mol·L-1 NH4Fe(SO4)2溶液滴定至终点,再重复2次,测得平均值为30.00mL。
①该滴定达到终点时的现象
②待测钛液中TiOSO4的物质的量浓度是 。
已知X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)写出X、Y的元素符号:X、Y;
(2)W在元素周期表中的位置是;Z的原子结构示意图
(3)由X、Y、Z所形成的离子化合物的化学式是,它与W的最高价氧化物的水化物的溶液反应时的离子方程式是;
(4)用电子式表示Y的氢化物的形成过程。
在下列事实中,什么因素影响了化学反应速率?
(1)熔化的KClO3放出气泡很慢,加入少量MnO2后很快产生气体_____________;
(2)同浓度、同体积的盐酸放入同样大小的锌块和镁块,产生气体有快有慢_____________;
(3)夏天的食品易变霉,冬天就不易发生该现象_____________。
下列反应中,属于放热反应的是_____________,属于吸热反应的是___________。
| A.盐酸与烧碱溶液反应 |
| B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑ |
| C.氢气在氧气中燃烧生成水 |
| D.高温煅烧石灰石使其分解 |
E.铝和盐酸反应
F.葡萄糖在人体内氧化分解
已知A、B、 C、 D四种物质都含有一种共同的元素,相互转化的关系如图所示:
其中,A是一种淡黄色的固态非金属单质,B是H2S,C是一种无色有刺激性气味的气体,并能使品红溶液褪色,D是H2SO4。
(1)根据以上信息推断:A:C:(填化学式)
(2)从A、 B、 C、 D四种物质中任选一种,从他们所含共同元素的价态上预测该物质具有氧化性或还原性,并设计实验验证:
我的预测:
主要操作:
可能的现象:
化学方程式:
下表是元素周期表的一部分,按要求填空(填元素符号或化学式)
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 2 |
A |
B |
||||||
| 3 |
C |
D |
E |
F |
G |
H |
I |
(1)在这些元素中最活泼的金属元素是,最活泼的非金属元素是,最不活泼的元素是。
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是,碱性最强的是,呈两性的氢氧化物是。
(3)在C与D的单质中,化学性质较活泼的是,判断依据之一是;在H与G的单质中,化学性质较为活泼的是,判断依据之一是。