已知: 2Fe2+ + Br2=2Fe3++2Br-;Cl2+2Br-= Br2+2Cl-
在含n mol FeBr2的溶液中,通入Cl2,有x mol Cl2发生反应。
(1)当 时,反应的离子方程式为_________________________
时,反应的离子方程式为_________________________
(2)当反应的离子方程式为:3Cl2+2Fe2+ +4Br-=2Br2+2Fe3+ +6Cl-时,x与n的关系为_____
(3)当Fe2+和Br-同时被氧化时,x与n的关系是_______________
(4)当x=n时,反应后氧化产物的物质的量为________________
有A、B两种烃,它们的组成相同,都约含86%的碳,烃A对氢气的相对密度是28;烃B式量是烃A的一半,烃A、B都能使溴的四氯化碳溶液褪色,根据以上实验事实回答问题。
(1)推断A、B两烃的化学式。
A;B。
(2)A存在同分异构体,同分异构体的名称。(有多少写多少)
(3)写出B与溴的四氯化碳溶液反应的化学方程式:。
蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
(1)若此蓄电池放电时,该电池某一电极发生还原反应的物质是(填序号)。
| A.NiO2 | B.Fe | C.Fe(OH)2 | D.Ni(OH)2 |
(2)用此蓄电池分别电解以下两种溶液,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一电极增加了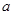 g M,则金属M的相对原子质量为(用含“
g M,则金属M的相对原子质量为(用含“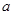 、x”的表达式表示)。
、x”的表达式表示)。
②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100mL,阳极产生的气体在标准状况下的体积是;将电解后的溶液加水稀释至1L,此时溶液的PH=。
(1)有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是。
(2)向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为_______________。
(3) 现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是_______________
①20 mL 0.01 mol·L-1KCl溶液
②30 mL 0.02 mol·L-1CaCl2溶液
③40 mL 0.03 mol·L-1HCl溶液
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液
(4)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。此电池的负极发生的电极反应式是_______________;
(5)某酸H2B在水溶液中有如下变化:H2B H++HB-;HB-
H++HB-;HB- H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题:
①溶液中的H+物质的量取值范围是:
②已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是0.11 mol·L-1(填“<”,“>”,或“=”)
“天蓝蓝海蓝蓝,海边小城威海卫”。威海海水资源丰富,回答下列问题:
(1)海水中主要含有等离子(写离子符号,至少答出4种)。
(2)海水脱硫是一种有效除去火力发电产生的SO2的方法。其工艺流程如下图所示:
天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是:;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是。
(3)下图是海水综合利用的一个方面。
请回答下列问题:
I.①步主要反应的离子方程式:。
溴及其化合物的用途有很多,写出其中的一种。
II.第③步需要加入,其前面分离出氢氧化镁的操作称为,将镁条在二氧化碳中燃烧的产物为。
III.粗盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤正确的操作顺序是
某同学欲探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铁、铜反应的实验中的有关问题。
(1)在常温下,分别向盛有等量铁片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸 ④稀硝酸,能观察到发生明显反应的是(填序号,下同),无明显反应现象的是。
(2)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸 ④稀硝酸,能观察到随即发生剧烈反应的是,开始不反应,加热后发生反应的是,加热也不发生反应的是。能缓慢发生反应或微热时能发生反应的是,反应的离子方程式为: ;
先将铜与浓硫酸反应产生的气体X持续通入下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括。
a.通入X气体后先产生白色沉淀后溶解
b.通入X气体后溶液中无明显现象
c.通入Y气体后有沉淀产生
d.通入Y气体后沉淀溶解
e.通入Y气体后溶液中无明显现象
(3)若将(2)的Ba(OH)2换为氢硫酸,则通入X气体后的现象为,反应的化学方程式为。