元素周期表是学习物质结构和性质的重要工具,元素周期 律反映了元素性质的周期性变化规律。
律反映了元素性质的周期性变化规律。
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。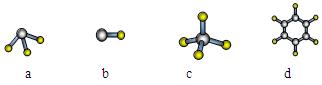
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到 强
强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
| 氢化物 |
A |
B |
HF |
D |
E |
沸 点/℃ 点/℃ |
1317 |
100 |
19.5 |
 33 33 |
 164 164 |
(每空各2 分,共20分)
(1)用A 质子数,B 中子数,C 核外电子数,D 最外层电子数,E.电子层数,用序号回答下列问题。
①原子种类由决定;②元素的化学性质由决定。
③质量数由决定。
(2)写出氟离子的结构示意图____ __;
(3)在标准状况下,4.48 L氨气(NH3)的物质的量为_____ ___,它与________ g H2S气体含有相同数目的氢原子;
(4)3.0g由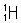 和
和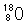 构成的水
构成的水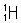 2
2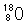 ,该水分子的物质的量为,含中子数为;
,该水分子的物质的量为,含中子数为;
(5)同温同压下,相同质量的H2和N2中物质的量之比为,密度之比为。
小美在五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。请完成下列问题: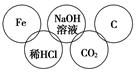
(1)五连环中发生的反应中
①属于置换反应的化学方程式为_________________________________________________;
②属于复分解反应的化学方程式为_________________________________________________;
③属于化合反应的化学方程式为__________________________________________________________。
(2)写出CO2与NaOH溶液反应的化学方程式_____________________________________________________。
(3)上述反应中属于氧化还原反应的有________个。
(12分)根据下列变化关系: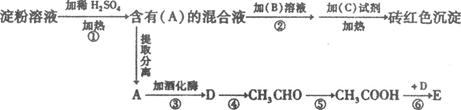
已知:E是一种具有果香味、难溶于水的物质,请填空:
(1)A物质的名称______________________ 。
B溶液为____________________________.作用为_________________________________。
(2)写出④、⑥两步反应的化学方程式,在( )号中标明反应类型。
④ _______________________________________________________ ( )
⑥_________________________________________________________ ( )
(7分)对于CH4、C3H4、C2H4、C2H6、C3H6五种烃,回答下列有关问题:
(1)等质量的上述五种烃,在相同状况下体积最大的是______________ 。
(2)等质量的上述五种烃,完全燃烧生成CO2最多的是________________。
(3)在120 ℃、1.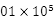 Pa条件下,与足量的O2混合点燃,完全燃烧前后气体体积没有变化的烃是___________________________。
Pa条件下,与足量的O2混合点燃,完全燃烧前后气体体积没有变化的烃是___________________________。
(9分)依据事实,写出下列反应的热化学方程式。
(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O。 放出571.6kJ的热量,
表示H2燃烧的热化学方程式为______________。
(2)在25℃、101kPa下,1g甲醇液体燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇
燃烧热的热化学方程式为________________________________________________
(3)已知:已知:C(s)+O2(g)=CO2(g) ΔH=-437.3 kJ·mol一1
H2(g)+ O2(g)=H2O(g) ΔH=-285.8 kJ·mol一1
O2(g)=H2O(g) ΔH=-285.8 kJ·mol一1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol一1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol一1
则煤的气化主要反应(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式是
_______________________________________