火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100℃~1300℃,使锌蒸馏出来(设空气中N2、O2的体积分数分别为0.8、0.20),主要反应为:
焙烧炉中:2ZnS(s) + 3O2(g) → 2ZnO(s) + 2SO2(g) ①
鼓风炉中:2C(s) + O2(g) →2CO ②
鼓风炉中:ZnO(s) + CO(g) Zn(g)+CO2(g) ③
Zn(g)+CO2(g) ③
(1)已知闪锌矿中含硫16%(其它杂质不含硫),则闪锌矿中硫化锌的含量为 。
(2)焙烧炉产生的炉气中SO2的体积分数不超过 %(保留小数后一位数字)。
⑶鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
| 时间/min |
CO |
Zn |
CO2 |
| 0 |
0.11 |
0 |
0 |
| 2 |
0.10 |
0.01 |
0.01 |
| 3 |
0.01 |
0.10 |
0.10 |
| 4 |
0.01 |
0.10 |
0.10 |
则鼓风炉中CO总的转化率为 ;若生产中CO总的利用率为95%,则每生产1molZn,至少需要补充焦炭 g。
⑷若ZnS全部转化为Zn。焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,则每生产1mol Zn,应向焙烧炉和鼓风炉中鼓入新鲜空气共 L(S.T.P)。
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
(1)B中反应的离子方程式是 .
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在________ .
(3)资料显示:SCN -的电子式为  .甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN﹣中被氧化的元素是 .
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol.
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1)写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN﹣被双氧水氧化为HCO3﹣,同时放出NH3,该反应的离子方程式:_______ 。
(2)Cu2+可作为双氧水氧化CN﹣中的催化剂。某兴趣小组要探究Cu2+对双氧水氧化CN﹣是否起催化作用,请你完成下实验方案。填写实验步骤、实验现象和结论(己知:CN﹣浓度可用离子色谱仪测定)
| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,________________________________ ___________________________________________ ___________________________________________ __________________________________________ |
现象与结论: 若____________________________ _______________________________ 若____________________________ ____________________ |
孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2。以孔雀石为原料可制备CuSO4·5H2O步骤如下:
(1)写出孔雀石与稀硫酸反应的化学方程式:___________,
为了提高原料浸出速率,可采取的措施有____________(写出两条)。
(2)溶液A的金属离子有Cu2+、Fe2+。实验步骤中试剂①最佳选 (填代号)。
a.KMnO4 b.Cl2 c.H2O2 d.HNO3
(3)溶液B中加入CuO作用是_________________ ____。
(4)常温下Fe(OH)3的Ksp=1×10-39,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10—3mol/L,必需将溶液pH调节至 。
(5)由溶液C获得CuSO4·5H2O晶体,需要经____________、___________和过滤。
(6)可用KMnO4标准溶液测定溶液A中Fe2+的浓度,量取A溶液20.00ml,用0.010mol/L酸性KMnO4标准溶液滴定,消耗KMnO4 10.00ml, A溶液中Fe2+的物质的量浓度_________mol/L.
(反应原理:MnO4- + 5Fe2++8H+=Mn2++5Fe3++4H2O)
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是 (填序号).
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示.B、C两点的平衡常数K(B)K(C)(填“>”、“=”或“<”).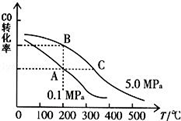
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得
c(CO)=0.25mol/L,CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字).
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V 20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小排列顺序____________
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为__________ .
(4)己知:CH3OH、H2的燃烧热(△H)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是 .
有机物A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):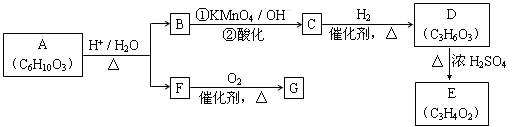
已知: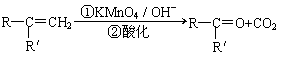 (R、R'可表示烃基或官能团)
(R、R'可表示烃基或官能团)
请回答:
(1)F蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量钠作用产生H2 22.4 L(标准状况),则F的分子式是________________。
(2)G与F的相对分子质量之差为4,则G的性质是________(填字母)。
a.可与银氨溶液反应
b.可与乙酸发生酯化反应
c.可与氢气发生加成反应
d.1 mol G可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是______________
(4)B的同分异构体较多,写出一种不含甲基能发生银镜反应的同分异构体结构简式: ____________。
(5)A转化为B和F的化学方程式是__________________。
(6)某烃分子H的碳原子数小于10,核磁共振氢谱只有一组峰, 在相同条件下也可发生类似B → C的反应并只生成一种有机物I,I的结构简式: ___________。
(16分)柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业。下图是两种不同方法制备一水柠檬酸晶体(C6H8O7·H2O)的工艺流程图。回答相关问题:
【资料卡片】:
①柠檬酸水溶液显酸性,柠檬酸钙不溶于水;
②工业生产柠檬酸,原料预处理后,得到的发酵液中
含有柠檬酸及其他可溶性杂质;
③一水柠檬酸在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
… |
| 溶解度/g |
96 |
118 |
146 |
183 |
216 |
… |
④某种专用树脂对柠檬酸的吸附率和水温的关系如图:
【钙盐法制备】
(1)气体X是 (填化学式),实验室检验该气体的化学方程式为 ;
(2)操作1、2的名称是 ;
(3)操作3的目的是得到一水柠檬酸晶体,操作顺序是b → → a;(填序号)
a.过滤b.加热浓缩 c.冷却结晶 d.蒸发结晶
(4)工业生产中,可加入 (填序号)进行脱色处理;
A.活性炭B.明矾C.肥皂水
(5)洗涤CaSO4滤渣的目的是 ;
(6)母液可以循环,其中一定含有的溶质是 ;