(11分)氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
| 温度/℃ |
200 |
300 |
400 |
500 |
600 |
| 氨含量/% |
89.9 |
71.0 |
47.0 |
26.4 |
13. 8 8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是_____________________________________________________________________________。
(2)根据表中数据,在500℃合成氨反应达到平衡时,与反应前的体积相比,反应后体积缩小的百分率是____________(保留2位有效数字)。
(3)在一定温度下,将2 mol N2和6 mol H2通入到体积为2 L的密闭容器中,发生反应
N2+3H2 2NH3,2 min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=______________(用分数表示);欲使K增大,可以采取的措施是___________________。
2NH3,2 min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=______________(用分数表示);欲使K增大,可以采取的措施是___________________。
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是______(选填序号字母)
a.及时分离出NH3 b.升高温度c.增大压强 d.使用催化剂
(5)NH3也能分解为N2和H2,在相同条件下,测得分解后混合气体密度为分解前的2/3,则氨的分解率为_______。
(6)根据下图的能量变化,求下列反应的反应热。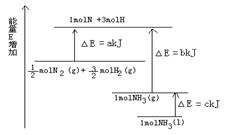
N2(g)+3H2(g) 2NH3(l) △H=___________。
2NH3(l) △H=___________。
氧化铝有两种变体,一种是αAl2O3,一种是γAl2O3,γAl2O3可用Al(OH)3在723 K时加热制得,它不耐酸;αAl2O3是天然刚玉的主要成分,硬度很大,且对酸有极强的稳定性。αAl2O3可以用γAl2O3高温煅烧制得。已知氧化铝可由铝铵矾加热制得,铝铵矾[(NH4)Al(SO4)2·12H2O]受强热分解的产物为:Al2O3、NH3、N2、SO3、SO2和H2O。
(1)写出铝铵矾受强热分解的化学方程式_____________________________________
________________________________________________________________________,
氧化产物是________,还原产物是________,它们的物质的量之比为________。
(2)在含有1 mol的铝铵矾溶液中,需加入________molBa(OH)2,沉淀的物质的量最大,离子方程式为______________________________________________________________
________________________________________________________________________。
(3)将上述反应中的Al2O3加入适量的氧化铬,在氢氧焰上强热,熔融后使其结晶,可以制成人造红宝石,可用于做激光器材和装饰品。所得人造红宝石是哪种Al2O3的变体?________,如何用简单方法证明是该变体______________________________________
________________________________________________________________________。
某新型无机非金属材料A,由两种非金属元素组成,其中所含元素的化合价为其最高正价或最低负价,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。A可由化合物B经下列反应制得:①B+NH3―→C[C的化学式为Si(NH2)4];②C经隔绝空气高温分解得到A。为探究B的组成,进行了下图所示的转化实验,图中G、F、H均为难溶于水的物质,且为白色粉末,图中字母代表的均为中学化学常见的物质。
请回答下列问题:
(1)写出化合物B和化合物G的化学式__________、________。
(2)写出反应②的离子方程式: ___________________________________________。
(3)写出C经隔绝空气高温分解得到A的化学方程式:
________________________________________________________________________。
(4)分析反应③,你能得出的结论是________________________________________(合理即可)。
硼砂(Na2B4O7)与NH4Cl共热,再用盐酸、热水处理,可得到白色固体氮化硼(BN)。
(1)配平方程式:________Na2B4O7+________NH4Cl===__________NaCl+__________B2O3+__________BN+________。
(2)BN是一种新型无机材料,它有两种结构,一种具有石墨结构,可作为润滑材料,它具有的性质是__________;一种具有金刚石结构,可作耐磨材料,它具有的性质是__________________________。
中国北京曙光公司研制出了第一款具有我国完全自主知识产权的高性能CPU芯片——“龙芯”1号。
(1)“龙芯”(芯片)的主要化学成分是________。
(2)在计算机长距离联网使用的传输很快的线路,其使用的材料叫________,主要化学成分是________。
(3)如果这种埋在地下的材料裸露在碱性土壤中,结果会断路,用离子方程式说明原因 ________________________________________________________________________。
玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂由苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中________加入甲醛,且反应釜应装有________装置。
(2)玻璃纤维由玻璃拉丝得到。普通玻璃是由石英沙、________和石灰石(或长石)高温熔融而成,主要反应的化学方程式为______________________、_____________________。
(3)玻璃钢中玻璃纤维的作用是__________。玻璃钢具有________________________等优异性能(写出两点即可)。
(4)下列处理废旧热固性酚醛塑料的做法合理的是______(填字母代号)。
a.深埋
b.粉碎后用作树脂填料
c.用作燃料
d.用有机溶剂将其溶解,回收树脂