二甲醚与水蒸气重整制氢气作为燃料电池的氢源,比其他制氢技术更有优势。主要反应为:
① CH3OCH3(g) + H2O(g) 2CH3OH(g) ΔH=+37 kJ·mol-1
2CH3OH(g) ΔH=+37 kJ·mol-1
② CH3OH(g) + H2O(g)  3H2(g) + CO2(g) ΔH=+49 kJ·mol-1
3H2(g) + CO2(g) ΔH=+49 kJ·mol-1
③ CO2(g) + H2(g) CO(g) + H2O(g) ΔH=+41.3 kJ·mol-1
CO(g) + H2O(g) ΔH=+41.3 kJ·mol-1
其中反应③是主要的副反应,产生的CO能毒害燃料电池Pt电极。请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为
。
(2)CH3OCH3(g)与水蒸气重整制氢气的热化学方程式为
。
(3)下列采取的措施和解释正确的是 。(填字母序号)
A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在低温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,对制取氢气不利,且对减少CO的产生几乎无影响
(4)在温 度相同的3个密闭容器中,按不同方式
度相同的3个密闭容器中,按不同方式 投入反应物,保持恒温、恒压,发生反应①,测得反应达到平衡时的有关数据如下。
投入反应物,保持恒温、恒压,发生反应①,测得反应达到平衡时的有关数据如下。
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol CH3OCH3、1mol H2O |
2mol CH3OH |
1mol CH3OH |
| CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
吸收a kJ |
放出b kJ |
放出c kJ |
| 平衡时体积(L) |
V1 |
V2 |
V3 |
| 反应物转化率 |
α 1 |
α 2 |
α 3 |
下列说法正确的是 。(填字母序号)
A. a+2c="37 " B. α1 + α2="1"  C. V1 > V3 D. c1=
C. V1 > V3 D. c1= 2c3
2c3
(5)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极也可直接构成燃料电池。该电池中负极上的电极反应式是  。
。
已知:①x是短周期元素组成的单质,Z是一种常见化合物。②A、B、C、D、E、F都是常见的化合物,常温下C是气体,D是液体。A溶液的焰色反应为黄色。自然界中存在较多的E矿石,工业生产中常用这种矿石来制取F。③存在下列转化关系:
试回答:
(1)Y的电子式:,X元素在周期表中的位置
C分子中的化学键类型
(2)Y转化为Z的化学方程式:
A转化为E的离子方程式(Z过量):
(6分)目前,化学家们已合成了一系列有机物:
联苯联三苯联四苯联m苯
根据这一系列有机物的规律,试回答:
(1)写出联m苯的化学式(用m表示)
(2)该系列有机物中,其中含碳量最高的化合物碳含量百分率约为
(保留三位有效数字)
(3)若联苯中C—C能自由旋转,那么联苯的二氯取代物有种
(18分)A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D、C与F分别为同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为,其Y分子属于(填“极性”、“非极性”)分子。
(2)E是非金属元素,但能表现出一些金属元素的性质,请写出单质E与氢氧化钠溶液反应的离子方
程式
(3)一定条件下,A的单质气体与B的单质气体充分反应生成6.8g W气体[已知n(A):n(B)=3:1],可放出18.44 kJ热量,则该反应的热化学方程式
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以金属M和金属N为惰性电极,在电池的M极通入A的单质气体,N极通入C的单质气体,则N极的电极反应式。
(5)在10升的密闭容器中,通入2mol的FC2气体和3molC的气体单质,一定条件下反应后生成FC3气体,当反应达到平衡时,单质C的浓度为0.21mol/L,则平衡时FC2的转化率为。
(10分)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为。
(3)根据上述反应可推知。
a.氧化性:KBrO3 >H3 AsO4 b.氧化性:H3AsO4 >KBrO3
AsO4 b.氧化性:H3AsO4 >KBrO3
c.还原性:AsH3>X d.还原性:X >AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目: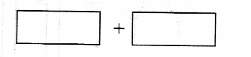
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸汽能发生氧化还原反应,其反应产物有:HF、NO、HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为。
(2)写出该反应的化学方程式。
若反应中生成0.2 mol HNO3,转移的电子数目为个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF 、H2O外,还肯定有(填化学式)。