(本题由I、II两部分组成,共16分)
【I】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常量下的无色无味气体。则甲的电子式为 ;丁溶于水时发生反应离子方程式为 .
(2)若丁为能使品红褪色的无色气体,丙为常见红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。
①写出生成丙的化学方程式 .
②向MCl2溶液中通入气体丁有白色沉淀(MCl)产生,该反应的离子方程式为 .
【Ⅱ】A、B、C、D均为中学化学中的常见物质,请根据题中信息回答下列问题:
(3)若它们存在如下反应转化关系:A+B→C+D(未配平,反应条件略去)。该转化关系中所涉及的反应为 非置换反应,且A、D分子的核外电子总数都为10个,B与C能发生反应,则反应的方程式是 。
(4)若它们存在如下反应转化关系:A+B→C+D+H2O(未配平,反应条件略去).
①该转化关系中所涉及的反应为氧化还原反应。若C、D两种气体均能使澄清石灰水变浑浊,鉴别C、D两种气体不能选用下列试剂中的 (填写字母编号).
A.Ba(OH)2溶液
B.酸性KMnO4溶液
C.紫色石蕊试液
D.H2O2与BaCl2混合液
E.酸化的Ba(NO3)2溶液
②该转化关系中所涉及的反应为非氧化还原反应。若A是造成温室效应的主要气体之一,C、D均为钠盐,D与B反应能转化为C。当参加反应的A、B物质的量之比为3:4时,则反应所得溶液中各种离子的浓度由大到小的顺序为 .
③若该反应为氧化还原反应,A是一种气体,B、D溶液显碱性,且D溶液具有强氧化性,则在绿矾溶液中加入少量D溶液,发生反应的离子方程式为 .
准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀A,向滤液中加入10mol/L的KOH溶液,产生沉淀的质量和加入的KOH溶液的体积(mL)如右图所示。试回答下列问题: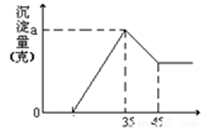
(1)沉淀A是(填化学式),当加入KOH溶液的体积超过35mL时所发生的反应的离子方程式为(4分)
(2)铝土矿中Al2O3的物质的量是多少?(2分)
(3)稀硫酸溶液的物质的量浓度为多少?(忽略溶液体积的变化)(2分)
如图所示:丁可能是强酸也可能是强碱。
(1)若丙是潜艇的供氧剂,请写出甲与水反应的离子方程式;若等物质的量的甲,乙,丙,丁的固体投入到足量且等量的水中完全反应所得溶液的质量分数由大到小的顺序是(用化学式表示)。
(2)若乙是能使品红溶液褪色的气体,请写出乙→丙的化学反应方程式;请写出乙可使氯水褪色的离子方程式__________________________.
(3)若甲可作为制冷剂,请写出甲→乙的化学反应方程式;将等量的铜粉分别与过量浓的丁溶液、稀的丁溶液反应,消耗丁的物质的量:前者后者,反应中转移的电子总数:前者后者(填“>”、“=”或“<”)
某学生课外活动小组利用下图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是溶液;加热时溶液由红色逐渐变浅的原因是。(用化学反应方程式表示)
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是溶液;加热时溶液由无色变为红色的原因。
(本题共2小题,共10分)
(1)相同温度下等物质量浓度的下列溶液中,
| A.NH4Cl | B.NH4HCO3 | C.NH4HSO4 | D.(NH4)2SO4 |
①pH值由大到小的顺序是(用对应的字母填写)。
②NH4+离子浓度由大到小的顺序是(用对应的字母填写)。
③若上述溶液的pH值相同,则其物质的量浓度关系是(用对应的字母填写)。
(2)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=________。
②完全沉淀后,溶液的pH=________。
如图为相互串联的甲、乙两电解池。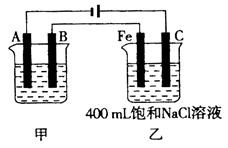
试回答:
(1)若甲电解池利用电解原理在铁上镀银,则A是(填电极材料),B是(填电极材料),应选用的电解质溶液是。
(2)乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈____色。乙电解池的电解方程式为。
(3)若甲电解池阴极增重4.32g,则乙槽中阳极上放出的气体在标准状况下的体积是mL。
(4)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液的pH等于。