[化学一选修2:化学与技术](15分)随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下: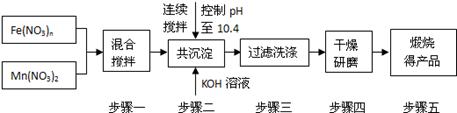
(1)原料Fe(NO3)n中n= ,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为 。
(2)步骤二中“连续搅拌”的目的是 ;步骤三中洗涤干净的标准是 。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4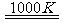 MnFe2O4-x+
MnFe2O4-x+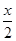 O2↑
O2↑
MnFe2O4+xH2O=MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分比为 。
②该热化学循环法制氢的优点有(答两点即可) 。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是 。
工业上从海水 提取溴,涉及到“浓缩”、“氧化”、“提取”等步骤,其中在“提取”过程中,可用空气把溴吹出,然后用碳酸钠溶液吸收,这时溴转化为Br-离子和BrO3-离子,同时有二氧化碳气体生成。最后用硫酸酸化,单质溴又从溶液中析出。
提取溴,涉及到“浓缩”、“氧化”、“提取”等步骤,其中在“提取”过程中,可用空气把溴吹出,然后用碳酸钠溶液吸收,这时溴转化为Br-离子和BrO3-离子,同时有二氧化碳气体生成。最后用硫酸酸化,单质溴又从溶液中析出。
(1)写出单质溴与碳酸钠溶液反应的化学方程式________________________________。
(2)用硫酸酸化时,每转移1 mol电子,可以生成单质溴___________ mol。
(3)已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
②Br2能将I¯氧化为I2;
③KIO3能将I¯氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2。
Br2、BrO3-、I2、IO3-的氧化性由强到弱的顺序为__________________________。
(4)以下离子方程式错误的是______________(选填答案编号)。
| A.IO3-+ Br-→I-+ BrO3- |
| B.6I-+ BrO3-+ 6H + → 3I2 + Br-+ 3H2O |
C.5I-+ 6BrO3-+ 6H + →3 Br2+ 5 IO3 -+ 3H2O -+ 3H2O |
D.5I-+ 2BrO3 -+ 6H + → Br2 + IO3-+ 2I2 + 3H2O -+ 6H + → Br2 + IO3-+ 2I2 + 3H2O |
我国的探月工程正在有计划的进行着,最近发射的嫦娥二号卫星又圆满完成了多项科学任务。月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8]和橄榄石(可分为铁橄榄石[Fe2SiO4]、镁橄榄石[Mg2SiO4]、铁-镁橄榄石[(Mg∙Fe)2SiO4])等。
(1)铁橄榄石中铁元素化合价为______,硅元素原子核外电子排布式为_____________。
(2)硅元素的原子核外共有______种不同能级的电子,其原子最外层共有_____种不同运动状态的电子。
(3)月球上的上述主要矿物中,属于短周期元素的原子半径由大到小依次为__________
(填相应的元素符号),在这些短周期元素中,其单质晶体微粒间存在两种相互作用的是_____元素。
(4)某元素与氧元素同周期,且与氧元素组成的化合物中氧元素显正+2价,写出一个化学方程式 ,说明该元素与氧元素的非金属性的强弱______________________
,说明该元素与氧元素的非金属性的强弱______________________ __。
__。
不同卤素原子间可以通过共用电子对,形成卤素互化物,其通式为:XX′n(n
= 1,3,5,7;且非金属性X′>X)。卤素互化物大多为强氧化剂。回答下列问题:
(1)卤素互化物中,沸点最低的应是(写分子式,下同)。
(2)若n = 7,则最可能生成的卤素互化物应为。
(3)现将23.3gBrCln溶于水,再通入过量SO2,生成HBr、HCl、H2SO4等三种酸,然后向该混 合酸溶液中加入过量Ba(NO3)2溶液后,过滤,最后向滤液中加入过量的硝酸银溶液,结果可生成77.3g沉淀,求n的值(写出计算过程)。
合酸溶液中加入过量Ba(NO3)2溶液后,过滤,最后向滤液中加入过量的硝酸银溶液,结果可生成77.3g沉淀,求n的值(写出计算过程)。
(4)某卤素互化物与水的反应为 ClFn + H2O → HClO3 + Cl2 +O2 + HF,若ClFn与H2O的物质的量之比为3∶5,求n的值(写出计算过程)。
氢氧化钡是一种广泛使用的化学试剂,现通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50g试样溶于蒸馏水配成100ml溶液,从中取出10.0ml溶液于锥形瓶中,加2滴指示剂,用0.1000mol/L的标准盐酸溶液滴定至终点,共消耗标准液20.0ml(杂质不与酸反应),该试样中氢氧化钡的物质的量为____________;
(2)取5.25g试样加热至恒重(杂质受热不分解),称得质量为3.09g,求Ba(OH)2·nH2O中的n 的值(写出计算过程)
的值(写出计算过程)
分子式为C8H13O2Cl的有机物A在不同条件下能发生如下图所示的一系列转化:
(1)写出下列有机物的结构简式
A__________________,B___________________,C___________________
(2)用化学方程式表示下列反应
① A与NaOH溶液共热:___________________________________________
② F与KOH醇溶液共热:__________________________________________
③ C→G: _______________________________________________
_______________________________________________
(3)G的氧化产物与C在一定条件下反应生成环状化合物的化学方程式:
___________________________________________________________
G的氧化产物与C在一定条件下反应生成高分子化合物的结构简式_______________。