工业上从海水 提取溴,涉及到“浓缩”、“氧化”、“提取”等步骤,其中在“提取”过程中,可用空气把溴吹出,然后用碳酸钠溶液吸收,这时溴转化为Br-离子和BrO3-离子,同时有二氧化碳气体生成。最后用硫酸酸化,单质溴又从溶液中析出。
提取溴,涉及到“浓缩”、“氧化”、“提取”等步骤,其中在“提取”过程中,可用空气把溴吹出,然后用碳酸钠溶液吸收,这时溴转化为Br-离子和BrO3-离子,同时有二氧化碳气体生成。最后用硫酸酸化,单质溴又从溶液中析出。
(1)写出单质溴与碳酸钠溶液反应的化学方程式________________________________。
(2)用硫酸酸化时,每转移1 mol电子,可以生成单质溴___________ mol。
(3)已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
②Br2能将I¯氧化为I2;
③KIO3能将I¯氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2。
Br2、BrO3-、I2、IO3-的氧化性由强到弱的顺序为__________________________。
(4)以下离子方程式错误的是______________(选填答案编号)。
| A.IO3-+ Br-→I-+ BrO3- |
| B.6I-+ BrO3-+ 6H + → 3I2 + Br-+ 3H2O |
C.5I-+ 6BrO3-+ 6H + →3 Br2+ 5 IO3 -+ 3H2O -+ 3H2O |
D.5I-+ 2BrO3 -+ 6H + → Br2 + IO3-+ 2I2 + 3H2O -+ 6H + → Br2 + IO3-+ 2I2 + 3H2O |
按要求填空
(1)CH2=CH—CH2—Br中含有官能团的名称:
(2)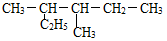 的系统命名:
的系统命名:
(3)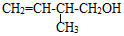 的键线式:
的键线式:
(4)下列五种有机物:能发生催化氧化为醛类物质能发生消去反应,消去反应产物有2种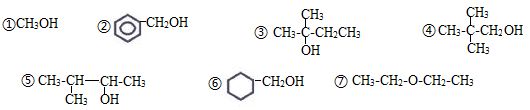
(12分,每空2分)单体液晶(有机物III)是用偶联反应合成的:
反应①
反应②
试回答以下问题:
(1)有机物Ⅰ的分子式是;有机物Ⅲ不能发生的反应为:
①取代反应、②加成反应、③醇氧化为醛(或酮)④消去反应
(2)以苯为原料生成有机物II的化学方程式为。
(3)由有机物III制备  的反应条件是。
的反应条件是。
(4)写出有机物III符合下列条件的同分异构体的结构简式(任写一个):
①苯环上有2个取代基,且环上一氯代物只有2种;②结构中含醛基,且醛基连在苯环上。
(5) 与CH3I能发生类似①的反应,该反应方程式是:。
与CH3I能发生类似①的反应,该反应方程式是:。
(10分,每空1分)I(1)下列四种烃分别在氧气中完全燃烧:(填字母序号)
①若烃的物质的量相等,则消耗氧气最多的是;
②若烃的质量相等,则消耗氧气最多的是;
③若反应前后(150℃)气体的物质的量不发生变化,则该烃可能是。
A.C2H6 B.C2H4 C.C4H10 D.C5H10
(2)下列各组化合物中,不论二者以什么比例混合,完全燃烧时:
①若总质量不变,耗O2量不变的是;生成水的质量不变的是。
②若总的物质的量不变,则耗O2量不变的是;生成CO2的质量不变的是。
A.C2H4、C3H6 B.HCHO、CH3COOH
C.CH4、CH3COOH D.CH2==CH2、CH3CH2OH
II.标准状况下,1.68 L无色无味的可燃性气体在足量氧气中完全燃烧,若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,增重9.3 g。
(1)计算燃烧产物中水的质量为。
(2)若原气体是单一的烃类气体,通过计算推断它的化学式:。
(3)若原气体是两种等物质的量的气态烃的混合物,请写出它们的结构简式(要求写出一组符合条件的物质的结构简式即可):。
(6分,每空1分) 有A、B两种烃,其相关信息如下:
| A |
①完全燃烧的产物中n(CO2)∶n(H2O)=2∶1 ②28<M (A)<60 ③不能使溴的四氯化碳溶液褪色 ④一氯代物只有一种结构 |
| B |
①饱和链烃,通常情况下呈气态、②有同分异构体、③二溴代物有三种 |
回答下列问题:
(1)烃A的实验式是;
(2)烃A的结构简式是_____________;
(3)烃B的三种二溴代物的结构简式为________________、________________、_________________;
(4)烃C为烃B的同系物,常温下为气态且只有一种一溴代物,则烃C的一溴代物的结构简式为(填一种即可)。
I.有以下物质:
①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;
⑦氢氧化钡溶液;⑧纯醋酸;⑨氯化氢气体。
(1)其中能导电的是;
属于非电解质的是;
属于强电解质的是;
属于弱电解质的是。
(2)写出物质⑥溶于水的电离方程式:。
(3)写出物质⑥和⑧在水中反应的离子方程式: 。
Ⅱ.今有K2SO4和Al2(SO4)3的混合溶液,已知其中K+浓度是0.2mol•L-1,SO42- 的浓度是0.7mol•L-1。
(4)则 Al3+ 物质的量浓度应等于。
Ⅲ.根据反应8NH3+3Cl2→ 6NH4Cl+N2,回答下列问题:
(5)该反应中氧化剂是,氧化产物是。
(6)该反应中被氧化的物质与被还原的物质物质的量之比为。
(7)用单线桥法标出电子转移的方向与数目。
IV.有一包白色固体,可能含有K2CO3、NaNO3、KCl、BaSO4、CuSO4。按下列步骤实验:①取少量固体溶于水,得到无色溶液;②在所得的溶液中滴加硝酸银溶液,得到白色沉淀,再加稀硝酸,白色沉淀部分溶解,并有气体产生。根据上述实验现象判断:
(8)一定存在的物质是;
(9)一定不存在的物质是 ;
(10)可能存在的物质是;