目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为: 。
它所对应的化学反应为: 。
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 |
容积/L |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| C(s) |
H2O(g) |
H2(g) |
||||
| 甲 |
2 |
T1 |
2 |
4 |
3.2 |
8 |
| 乙 |
1 |
T2 |
1 |
2 |
1.2 |
3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填字母)。
A.="0.8" mol·L-1 B.=1.4mol·L-1 C.<1.4 mol·L-1 D.>1.4mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平衡时各气体的体积分数与甲容器完全相同的是 (填字母)。
A.0.6 mol 1.0 mol 0.5 mol 1.0 mol
B.0.6 mol 2.0 mol 0 mol 0 mol
C.1.0 mol 2.0 mol1.0 mol2.0 mol
D.0.25 mol 0.5 mol 0.75 mol 1.5 mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
已知A、B、C、D四种短周期元素原子序数依次增大,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,B、C、D三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且X、Y、Z可两两相互反应生成盐和水,试推断并用相应的化学用语回答下列问题:
(1)D元素原子的结构示意图为_________________;
(2)X与C元素的最高价氧化物可以发生反应,该反应的离子方程式为___________________;
(3)A、B、C三种元素的原子半径由小到大的顺序为__________________________;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈___(填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序为_____________________。
为探究铁质材料与热浓硝酸的反应,某学习小组进行了以下实验:
[探究一]
(1)铁钉放在浓硫酸中浸泡后,再用蒸馏水冲洗,然后放入硫酸铜溶液中,铁钉表面无明显变化,其原因是_____________________。
(2)另称取铁钉6.0g放入15.0ml浓硝酸中,加热,充分应后得到溶液M并收集到气体N。为了探究溶液M中铁元素的价态,甲同学设计了如下实验:
有药品:
| A.稀盐酸溶液 |
| B.稀硫酸溶液 |
| C.淀粉KI溶液 |
| D.KMnO4溶液 |
E.NaOH溶液
F.H2O2溶液
G.KSCN溶液
仪器:试管和滴管
步骤1.取试样,滴加少量的______(填试剂字母),溶液的颜色变____色,则试样中含有Fe3+,发生反应的离子方程式为________________。
步骤2.再去适量的试样滴加少量的______(填试剂字母),若溶液_______,则试样中含有Fe2+。
[探究二]
乙同学设计以下装置探究气体N的成分。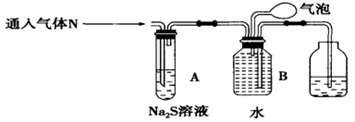
(3)A装置的作用:______________________。
(4)B装置收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体N中含NO____(填“能”或“不能”)?理由是________________。
聚苯乙烯可用于制备高频绝缘材料,苯乙烯在一定条件下存在如下图转化关系。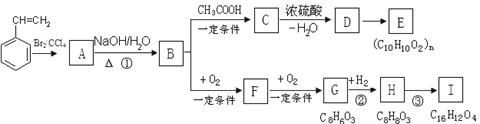
请回答下列问题:
(1)由苯乙烯合成这种高聚物的化学方程式为。
(2)反应①的反应类型是,C→D的反应类型是。
(3)C可能的结构简式有。
(4)H有多种同分异构体。同时符合下列条件的同分异构体共有种。
a.与FeCl3溶液发生显色反应
b.1 mol H最多能与3 mol NaOH反应;
c.苯环上只有两个取代基。
(5)反应③的化学方程式是。
快乐是什么?精神病学专家通过实验发现:在大脑的相应部位—-“奖赏中心”,给予柔和的电击,便会使大脑处于极度快乐的状态。人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺结构如下图: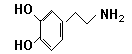
(1)试判断多巴胺能发生的化学反应。
| A.加成 | B.消去 | C.氧化 | D.水解 |
(2)写出与多巴胺互为同分异构体且属于1,3,5-三取代苯并且苯环上直接连有一个羟基和一个氨基且分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2:1的所有物质的结构简式:
。
(3)多巴胺可由香兰素与硝基甲烷缩合,再经锌-盐酸还原水解而得。合成过程表示如下: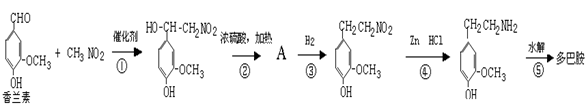
请写出②、⑤两步的化学方程式:
②:
⑤:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。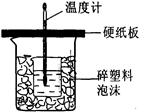
请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________,烧杯间填满碎塑料泡沫的作用是_________________________。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小’、“无影响”)
(3)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶 液进行反应,与上述实验相比,所求中和热的数值会________(填“相等”或“不相等”),理由是______________________。
(4)设50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液反应的反应热为△H1,25mL0.5mol/L的浓硫酸与50mL0.55mol/L的NaOH溶液反应的反应热为△H2, 50mL0.5mol/L的醋酸与50mL0.55mol/L的NaOH溶液反应的反应热为△H3,则△H1、△H2、△H3的关系是。(用“>”“<”或“=”连接)