(14分)金属铜具有良好的导电性和导热性,在电气和电子工业中应用广泛。请回答下列问题:
(1)资料显示:加热条件下氨气能够还原CuO得到金属铜。某同学用装置I和Ⅱ制取纯净干燥的氨气,装置I中应选用试剂______(供选用的试剂有:NH4Cl固体、NH4HCO3固体),试剂a最好选用__________,其作用是_________________________________________;装置III吸收尾气,如何检验所得溶液中数目最多的阳离子(只回答试剂名称和实验现象)_____________________。
(2)电解硫酸铜溶液也可得到金属铜。
①以黄铜矿(主要成份为CuFeS2)为原料采用电解法可制取硫酸铜溶液。实验室用如图所示装置模拟其过程,阳极区稀硫酸的作用是溶解矿粉得到Cu2+、Fe2+、H2S,硫酸铁的作用是氧化吸收H2S,防止逸出造成污染。电解过程中,阳极区Fe3+的浓度基本保持不变,原因是(用电极反应式回答)______________,阴极上先有固体析出,然后又溶解,阴极区通入O2的作用是(用离子方程式回答)__________________。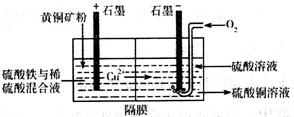
②用惰性电极电解一定浓度CuSO4溶液制取金属铜,一段时间后停止通电,此时加入9.8gCu(OH)2恰好能使电解质溶液恢复至初始状态,则该过程中阳极产生气体的体积为____________L(标准状况)。
我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
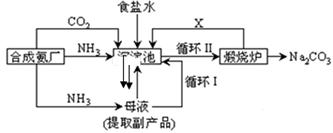
(1)沉淀池中发生的化学反应方程式是。
(2)写出上述流程中X物质的化学式。
(3)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是。
(4)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有。(填字母编号)
(a)增大NH4+的浓度,使NH4Cl更多地析出(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(1)指出氧在下列各物质中的化合价,分别写出由氧气在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①Na2O:,。
②Na2O2:,。
(2)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式。
(3)人体内O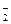 对健康有害,使人过早衰老,但在催化剂SOD存在下可以发生如下反应,请完成该反应的离子方程式:
对健康有害,使人过早衰老,但在催化剂SOD存在下可以发生如下反应,请完成该反应的离子方程式: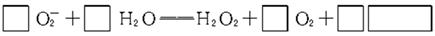
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Ba2+、C1—、SO42—、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
| 实验序号 |
实验内容 |
实验结果 |
| a |
加AgNO3溶液 |
有白色沉淀生成 |
| b |
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成标准 状况下的体积) |
| c |
加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6. 27g,第二次 称量读数为2.33g |
试回答下列问题:
(1)该混合物中一定不存在的离子是。
(2)溶液中一定存在的阴离子是。
(3)试写出实验b发生反应的离子方程式。
(4)判断混合物中是否存在K+?(填“是”或“否”)。
理由是。
某芳香族化合物A发生以 下反应:(已知B的相对分子质量为108.有机玻璃的结构简式为
下反应:(已知B的相对分子质量为108.有机玻璃的结构简式为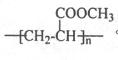 。)
。)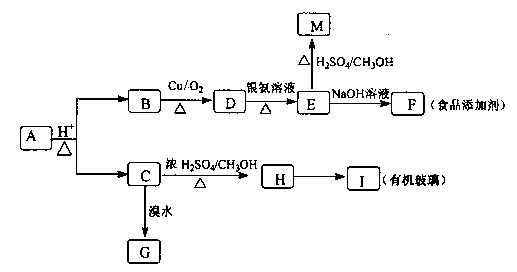
回答下列问题:
(1)A的分子式为。
(2)G的结构简式。
(3)B→D的反应类型,H-→I的反应类型。
(4)C→H的反应方程式 。
。
D→E的反应方程式。
(5)符合以下条件的M的同分异构体有种(不包括M)
①含有苯环结构②含有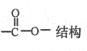
写出其中一种的结构简式。
某温度时,在2L密闭容器中气态物质CO和H2反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
| t/min |
CO/mol |
H2/mol |
Z/mol |
| 0 |
1.00 |
1.00 |
0.00 |
| 1 |
0.90 |
0.80 |
0.10 |
| 3 |
0.75 |
0.50 |
0.25 |
| 5 |
0.65 |
0.30 |
0.35 |
| 7 |
0.55 |
0.10 |
0.45 |
| 9 |
0.55 |
0.10 |
0.45 |
| 10 |
0.55 |
0.10 |
0.45 |
(1)(根据上表中数据,在下图中画出CO、z的物质的量的浓度(c)随时间(t)变化的曲线: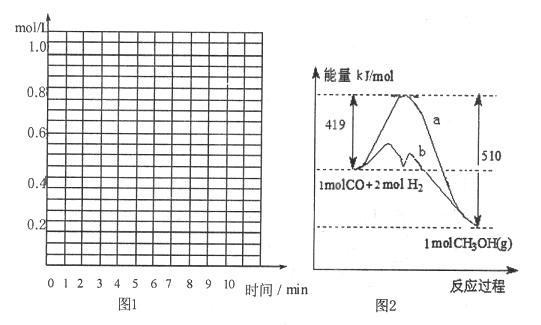
(2)体系中发生反应的化学方程式是。
(3)在3—5 min时间内产物Z的平均反应速率:。
(4)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是(填“吸热”或“放热”)反应,反应的热化学方程式是。
(5)恒容条件下,下列措施中能使n(CH3OH)/n(CO)增大的有(选填序号)。
a.升高温度 b.使用催化剂 C.再充人2 mol H2 d.再充人2 mol He