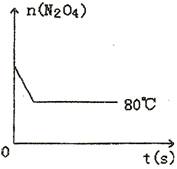
在80℃时,0.40mol的N2O4气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:

已知:
(1)计算20s~40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K= 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使c(NO2)/c(N2O4)值变小,可采取的措施有(填序号) 。
| A.增大N2O4的起始浓度 | B.向混合气体中通入NO2 |
| C.使用高效催化剂 | D.升高温度 |
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
置换反应的通式可表示为:
单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)单质甲是生活中用途最广泛的金属,单质乙是最轻的气体,写出离子方程式:。
(2)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,则该反应的化学方程式为。
(3)若乙是一种红色金属单质,化合物B的溶液呈浅绿色,则该反应的离子方程式为。
(4)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式。
(5)若单质乙是黑色非金属固体单质,化合物B是一种白色金属氧化物,则该反应的化学方程式。
(6)若化合物B为黑色磁性晶体,,气体单质乙能在空气中燃烧,写出该反应的化学方程式。
固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。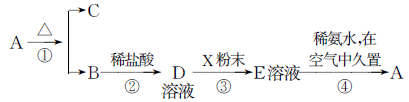
(1)写出下列物质的化学式:
A:__________,B:__________,D:__________,E:__________,X:__________。
(2)写出反应①的化学方程式:________________________________。
写出反应③的离子方程式: ________________________________。
写出反应④过程中,白色沉淀在空气中久置的化学方程式:________________。
某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。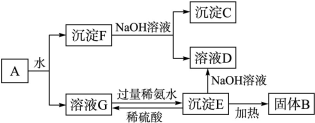
请回答下列问题。
(1)图中涉及分离溶液与沉淀的方法是____________________________。
(2) B、C、D、E四种物质的化学式为:
B__________、C__________、D__________、E__________。
(3) 写出下列反应的离子方程式:
沉淀F与NaOH溶液反应________________________________。
沉淀E与稀硫酸反应____________________________。
溶液G与过量稀氨水反应________________________________。
A、B、C、D、E为中学化学常见的单质或化合物,其相互转化关系如下图所示。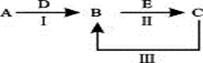
(1)若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子粒子。
①写出反应A→B的化学方程式;
②将一定量的气体D通入2 L C的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中所含溶质的化学式为,a点溶液中各离子浓度由大到小的关系是。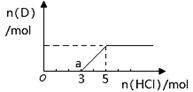
(2)若将(1)中的气体D通入氢氧化钡溶液中得不溶物F,F的KSP=8.1×10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其KSP,(填:增大、减小或不 变),组成不溶物F的阴离子在溶液中的浓度为mol/L。
有A、B两种烃,它们的组成相同,都约含86%的碳,烃A对氢气的相对密度是28;烃B式量是烃A的一半,烃A、B都能使溴的四氯化碳溶液褪色,根据以上实验事实回答问题。
(1)推断A、B两烃的化学式。
A;B。
(2)A存在同分异构体,同分异构体的名称。(有多少写多少)
(3)写出B与溴的四氯化碳溶液反应的化学方程式:。