我国的探月工程正在有计划的进行着,最近发射的嫦娥二号卫星又圆满完成了多项科学任务。月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8]和橄榄石(可分为铁橄榄石[Fe2SiO4]、镁橄榄石[Mg2SiO4]、铁-镁橄榄石[(Mg∙Fe)2SiO4])等。
(1)铁橄榄石中铁元素化合价为______,硅元素原子核外电子排布式为_____________。
(2)硅元素的原子核外共有______种不同能级的电子,其原子最外层共有_____种不同运动状态的电子。
(3)月球上的上述主要矿物中,属于短周期元素的原子半径由大到小依次为__________
(填相应的元素符号),在这些短周期元素中,其单质晶体微粒间存在两种相互作用的是_____元素。
(4)某元素与氧元素同周期,且与氧元素组成的化合物中氧元素显正+2价,写出一个化学方程式 ,说明该元素与氧元素的非金属性的强弱______________________
,说明该元素与氧元素的非金属性的强弱______________________ __。
__。
(本题共8分)阻燃剂又称防火剂,主要用于延迟或防止可燃物的燃烧。根据组成,阻燃剂可分为卤系阻燃剂、无机阻燃剂等。卤系阻燃剂多为有机氯化物和有机溴化物,受热会分解产生卤化氢(HX),起到阻燃作用。卤化氢的电子式为________;氯离子的结构示意图为________。
下列能说明氯的非金属性强于溴的事实是________(选填编号)。
a.HClO酸性强于HBrO
b.稳定性:HBr小于HCl
c.在二者形成的化合物BrCl 中氯显负价,溴显正价
无机阻燃剂中,氢氧化铝和氢氧化镁两种阻燃剂占据着重要位置。两者的阻燃机理都是在达到热分解温度时迅速分解为氧化物与水,起到吸热降温的作用。写出氢氧化铝在酸性溶液中的电离方程式_________ 。
写出氢氧化铝与氢氧化钠反应的离子方程式_______________。无水碳酸镁也是一种新型无机阻燃剂,除了具有单位质量吸热量更大的特点外,还能释放具有灭火作用的气体。写出该气体的结构式_______________。与镁离子核外电子排布相同的另外两个阳离子的半径大小关系为________(填微粒符号)。
假定元素周期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说。
(1)已知元素周期表中的各周期可排元素种类如下:
| 周期 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
| 元素种类 |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
人们预测元素周期表第八周期将来也会排满,那么该周期排满后的元素种数是 。
A.18 B.32 C.50 D.无法判断
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看做非金属元素),预测周期表中应该有 种非金属元素,还有 种未发现。未发现的非金属元素处于 周期 族。
(3)小明同学所在的化学探究小组,在查阅相关资料后归纳出元素周期表的另一种画法——三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。
回答下列问题:
①请在图中将过渡元素所在的位置涂黑。
②画出B元素价电子排布图 。
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号为 ;
(2)Y元素原子的价层电子的电子排布图为 ,该元素的名称是 ;
(3)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性 。
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,违反了泡利原理的是 ,违反了洪特规则的是 。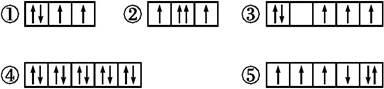
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为 ;其最高价氧化物对应水化物的化学式是 。
(3)用符号“>”“<”或“=”表示下列各项关系。
①第一电离能:Na Mg, Mg Ca。
②电负性:O F, F Cl。
③能量高低:ns (n+1)s, ns np。
④主族序数 价电子数 元素最高正化合价。
A、B、C、D、E、F代表6种元素。请填写下列空白。
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与Ar相同,B的元素符号为 ,C的元素符号为 。
(3)D元素的正三价离子的3d轨道为半充满,D的元素符号为 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
(5)F元素的基态原子的外围电子排布式为3d54s2,其原子结构示意图为 ,其最高正价为 ;位于元素周期表中第 周期 族。