X、Y、Z、W、M是元素周期表中原子序数依次增大的五种元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
元素周期表中核电荷数最小的元素 |
| Y |
Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z |
Z是大气中含量多的元素,其某些氧化物为大气中常见的污染物 |
| W |
W是地壳中含量最高的金属元素 |
| M |
常见金属,单质呈紫红色 |
(1)W位于元素周期表第 周期第 族;W的简单离子半径比Z的简单离子半径 (填“大”或“小”)。
(2)Z原子的第一电离能比氧原子的 (填“大”或“小”);M的基态原子价电子排布式是
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是 ,空间构型是
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途: 、 ;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:____。
(5)可用YX4还原ZOx以消除其污染。已知:
YX4 (g) +4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g) △H=" -" 574 kJ·mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g) +2X2O(g) △H =" -" 1160 kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:____。
酯类有机物E(C6H8O4)广泛用于涂料行业中,其合成路线如下(其中直链烃A的分子式为C4H8,核磁共振氢谱中有两种等效氢,没有支链;B的相对分子质量比A大69)。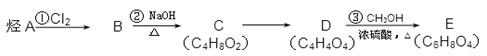
信息提示:①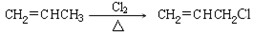
②R-CH2OH 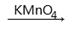 R-COOH
R-COOH
(1)烃A的结构简式为________________,D中官能团名称______________;
(2下列说法正确的是___________(填序号)。
a.反应①属于加成反应
b.B与二氯甲烷互为同系物
c.C能使溴水褪色
(3)C转化为D经过4步反应完成: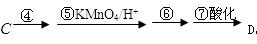 。
。
则,步骤④所需的无机试剂是___________;
步骤⑤的反应类型是_________________。(填“氧化”或“还原”)反应
步骤④⑥的设计目的是。
已知F为高分子化合物: 。
。
C分子结构中只含有一种氢。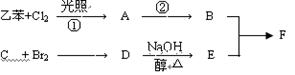
(1)写出下列物质结构简式
B:C:E:
(2)判断①②反应类型:、
(3)写出D→E的化学方程式
研究有机物一般经过以下几个基本步骤:分离、提纯 → 确定实验式 → 确定分子式 → 确定结构式。
已知:①2R-COOH + 2Na → 2R-COONa + H2 ↑
②R-COOH + NaHCO3 → R-COONa + CO2↑ + H2O
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 |
解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为。] |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团 。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有种氢原子。 综上所述, A的结构简式为。 |
(1)请根据官能团的不同对下列有机物进行分类:
①(CH3)3CCH2OH②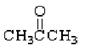 ③
③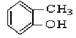
④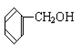 ⑤
⑤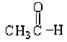 ⑥
⑥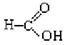
上述物质中,属于芳香醇的是,属于酚类的是属于羧酸类的是,属于醛类的是(填序号)
(2)下列属于同系物的是,属于同分异构体的是(填入编号)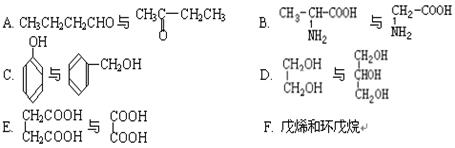
化合物A[KxFe(C2O4)y·zH2O,其中铁元素为+3价]是一种重要的光化学试剂。
(1)制备化合物A的实验流程如下: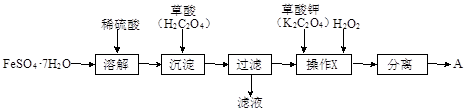
①上述流程中,检验“过滤”后的固体已洗涤干净的方法是。
②上述流程“操作X”中加入H2O2的目的是。
(2)测定化合物A的化学式实验步骤如下:
a、准确称取A样品4.91g,干燥脱水至恒重,残留物质的质量为4.37g;
b、将步骤a所得固体溶于水,加入还原铁粉0.28g,恰好完全反应;
c、另取A样品4.91g置于锥形瓶中,加入足量的3 mol/L的H2SO4溶液和适量蒸馏水,再加入0.50mol/L的KMnO4溶液24.0 mL,微热,恰好完全反应:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
请通过计算填空:
①4.91g A样品中含结晶水的物质的量为mol。
②A样品中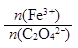 =。③A的化学式为。
=。③A的化学式为。