工业合成氨与制备硝酸一般可连续生产,流程如下: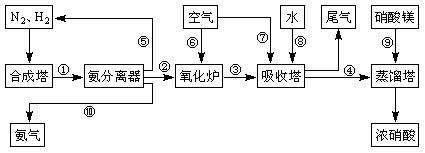
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的转化率α(H2O)=________。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
| T/K |
T1 |
573 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
T1____573K(填“>”、“<”或“=”)。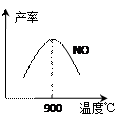 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同温度下NO产率如图所示。温度高于900℃时,
NO产率下降的原因 。
(4)吸收塔中发生反应的化学方程式为:
。
(5)上述工业流程中,采用了循环操作工艺的是 (填序号)
(6)硝酸厂的尾气含有氮氧化物,如果不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_____________________________。
Favorskii反应是化工生产中的重要反应,它是利用炔烃与羰基化合物在强碱性下发生反应,得到炔醇,反应原理为: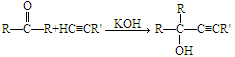
已知:
以下合成路线是某化工厂生产流程的一部分:
请回答下列问题:
(1)写出F中官能团的名称。
(2)写出D的名称(系统命名)。
(3)④的反应类型是;B的结构简式是。
(4)写出反应⑥的化学方程式为。
(5)H是D的同分异构体,核磁共振氢谱有3种峰且属于炔烃的结构简式为
、。
(6)有关C的说法正确的是
| A.能使溴的四氯化碳溶液褪色 | B.能和氢氧化钠溶液反应 |
| C.能使酸性高锰酸钾褪色 | D.能与乙酸发生酯化反应 |
X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的一种核素的质量数为18,中子数为10 |
| Y |
Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一 |
| Z |
Z的单质常温下为黄绿色气体 |
| W |
W的基态原子核外有4个未成对电子 |
(1)Z位于元素周期表的位置,写出Z的原子结构示意图。
(2)Y的电负性比Z 的(填“大“或”小”);X和Y的气态氢化物中,较稳定的是(写化学式)。
(3)X的一种氢化物H2X2分子中极性键和非极性健数目之比为。
(4)Z的一种单质与烧碱溶液作用可以生产日常生活用的消毒剂,请写出其反应的离子方程式:。
(5)已知28gW在氧气中燃烧,放出186.4kJ的热量,请写出此反应的热化学方程式:。
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: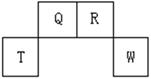
(1)W在周期表中的位置是, Q、R、T三种元素原子的半径从大到小排列顺序(用元素符号表示),Q的最高价氧化物的电子式,R气态氢化物分子的结构式为;
(2)元素的原子得电子能力:QW(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点(填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是(填名称);
(5)现有8种元素的性质、数据如下表所列,它们属于短周期:请指出R元素在下表中的对应编号,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号。
| ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
| 原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.6 |
0.75 |
0.82 |
| 最高或最低化合价 |
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
| -2 |
-3 |
-1 |
-3 |
氢氧燃料电池的实验装置如图所示,回答下列有关该实验的问题。
(1)要使发光二极管发亮,实验时的操作顺序是:先_______,电解一段时间后,__________;
(2)在实验的全过程中能量的主要转化形式是;
(3)写出下列两种操作时的电极反应式,并注明电极名称:
①按下开关S1,断开开关S2,一段时间后: C1为极,电极反应:;
②断开开关S1,迅速按下开关S2:(提示:此时C1附近溶液显碱性,C2附近溶液显酸性)C2为______极, 电极反应:。
(8分)取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7(填“>”、“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl,按pH由大到小的顺序排列(填序号)。 |