写出下列反应的离子方程式
(1)过氧化钠与水
(2)金属铝与稀硫酸溶液
(3)向Na2CO3与NaHCO3混和溶液加入CaCl2溶液
(4)Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无固体残留物存在,请用两个离子方程式表示有关生成H2的变化:
(A)
(B)
(5)把铜片放入稀硝酸中: ;
已知X+、Y3+、Z-、W2-是短周期元素X、Y、Z、W形成的离子,下图中的甲、乙、丙均是由上述四种离子中的两种组成的化合物。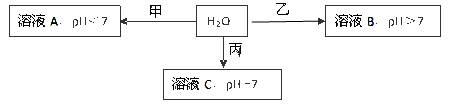
回答下列问题:
(1)通常状况下,Z的单质是一种黄绿色气体,工业上常用电解溶液C的方法制备该单质,制备反应的化学方程式是
(2)①甲的化学式是,乙的化学式可能是(写一种即可)
②若W2-和Z-具有相同电子层结构,则乙的电子式是
(3)Y单质可用来制造Y—空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。
①若以溶液C为电解质溶液时,正极的反应式为
②若以氢氧化钾溶液为电解质溶液时,电池的总反应式为
短周期元素Q、R、T、W在元素周期表中的位置如图所示,期中T所处的周期序数与主族序数相等,请回答下列问题: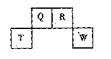
(1)T的原子结构示意图为。
(2)元素的非金属性为(原子的得电子能力):QW(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为。
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是。
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量akJ和bkJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的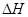 =(注:题中所设单质均为最稳定单质)。
=(注:题中所设单质均为最稳定单质)。
某温度时,把1molN2O4气体通入体积为5L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.6倍。
(1)、前4s中以N2O4的浓度变化表示的平均反应速度为mol/L·s
(2)、在4s时容器内的压强为开始时的倍
(3)、在平衡时容器内含N2O4mol
(4)、在平衡时容器内NO2的浓度为mol/L
(5)、N2O4的转化率为
能源短缺是人类社会面临的重大问题,而“原子经济”就是反应物的原子全部转化为期望的最终产物。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则H2的转化率为。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
| 键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列两组物质的熔点高低(填“>”或“<”):SiC_____Si,Si _____SiO2
(2)工业上高纯硅可通过下列反应制取: ,则2 mol H2生成高纯硅需_____ (填“吸收”或“放出”)能量_____ kJ。
,则2 mol H2生成高纯硅需_____ (填“吸收”或“放出”)能量_____ kJ。
(3)已知硅燃烧热的热化学方程式为Si(s)+O2(g)===SiO2(s) ΔH=-989.2kJ·mol-1,则O=O键键能为_____________。