通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
| 键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列两组物质的熔点高低(填“>”或“<”):SiC_____Si,Si _____SiO2
(2)工业上高纯硅可通过下列反应制取: ,则2 mol H2生成高纯硅需_____ (填“吸收”或“放出”)能量_____ kJ。
,则2 mol H2生成高纯硅需_____ (填“吸收”或“放出”)能量_____ kJ。
(3)已知硅燃烧热的热化学方程式为Si(s)+O2(g)===SiO2(s) ΔH=-989.2kJ·mol-1,则O=O键键能为_____________。
已知甲和乙在溶液中的转化关系如图所示:
请回答下列问题:
(1)若甲是10电子的单核微粒,乙是两性氢氧化物,则微粒甲的结构示意图为 。
(2)若甲是10电子的阳离子,乙是碱性气体。1mol乙通入足量强酸溶液中与H+反应,反应过程中能量变化如下图: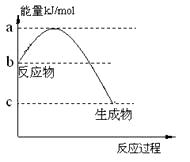
写出乙的一种用途: ;
该反应的热化学方程式是___________________________。
(3)若甲是CrO42-(黄色)和Cr2O72-(橙色)的混合溶液,在该溶液中存在如下平衡:
CrO42-(黄色) + 2H+ Cr2O72-(橙色) + H2O
Cr2O72-(橙色) + H2O
若测得甲溶液的pH=1,该溶液显 色。
(4)若甲仅含有NO3-、SO42-和X三种离子,则X离子可能是 (填序号) 。
| A.Fe2+ | B.HCO3- | C.Ba2+ | D.Fe3+ |
(5)若甲是CO2,乙中HCO3-和CO32-的物质的量浓度相等,此时溶液的pH=10,
则HCO3-的电离平衡常数Ka= 。
油脂A的通式为 (R中不含有三键)0.1 mol A与溶有96 g Br2的四氯化碳溶液恰好完全反应.0.1 mol A完全燃烧时生成的CO2和H2O的物质的量之和为10.6 mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.
(R中不含有三键)0.1 mol A与溶有96 g Br2的四氯化碳溶液恰好完全反应.0.1 mol A完全燃烧时生成的CO2和H2O的物质的量之和为10.6 mol.求油脂A的结构简式,写出油脂A完全氢化的化学方程式.
一种有机物的结构简式为: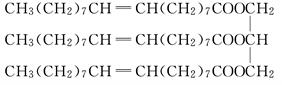
完成下列问题:
(1)该化合物含有的官能团是________(填名称).
(2)该化合物的类别是________(填字母序号,下同).
A.烯烃 B.酯 C.油脂 D.高分子化合物
E.混合甘油酯
(3)该化合物与水的混合物________.
A.与水互溶
B.不溶于水,水在上层
C.不溶于水,水在下层
(4)该物质是否有固定熔、沸点________(填“是”或“否”).
(5)与该物质能反应的物质有________.
A.NaOH溶液 B.碘水 C.乙醇 D.乙酸 E.H2
写出属于取代反应的化学方程式:
________________________________________________________________________.
如图为硬脂酸甘油酯在碱性条件下水解的装置图.
进行皂化反应时的步骤如下:
(1)在圆底烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g氢氧化钠、5 mL水和10 mL酒精.加入酒精的作用是______________.
(2)隔着石棉网给混合物加热约10 min,皂化反应基本完成,所得的混合物为________(填“悬浊液”、“乳浊液”、“溶液”或“胶体”).
(3)向所得混合物中加入________,静置一段时间,溶液分为上下两层,肥皂在________层,这个操作称为________.
(4)图中长玻璃导管的作用为__________________________________________.
(5)写出该反应的化学方程式:__________________________________.
2 mol油酸、1 mol硬脂酸与1 mol甘油完全反应,只生成一种甘油酯A,A可能的结构有________种.硬化1 mol A需标准状况下的H2________ L,反应的化学方程式为________________________________(A用其中一种结构表示,下同).A在NaOH溶液中加热发生________反应,反应的化学方程式为____________________________________.