离子反应是中学化学中重要的反应类型。回答下列问题 :
:
(1)在发生离子反应的反应物或生成物中,一定存在________。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。

(3)离子方程式是中学生应熟练掌握的化学用语,请写出下列反应的离子方程式:
向Ba(HCO3)2溶液中滴入NaHSO4 溶液,至沉淀完全,反应的离子方程式___________________________。在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为_______________________。
溶液,至沉淀完全,反应的离子方程式___________________________。在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为_______________________。
某氮肥厂,多年来生产碳铵化肥。由于工艺落后,设备老化,能耗高,产量低,产品单一,销路不畅,对环境污染严重,目前已资不抵债,无法进行设备更新和排污治理,面临倒闭困境。
(1)写出氮肥厂合成氨的化学方程式:____________________________________________。
(2)碳酸氢铵长期施于土壤中,一会破坏土壤的团粒结构,二会减少土壤微生物,从而造成土壤板结,降低地力和肥效,增加农业生产成本,这是造成产品滞销的主要原因之一。请写出复合肥磷酸二铵的分子式:__________________________。
(3)土壤中的硝化细菌分两类__________和__________。前者把氮氧化成亚硝酸的反应方程式为_____________________;后者把亚硝酸氧化成硝酸的过程是______________________。
(4)小氮肥厂对环境的污染主要包括三个方面:_____________对大气的污染,___________对土壤的污染,___________________对水体的污染。
(5)污水处理的设备和工艺很复杂,但其基本原理不过是对有害成分的_________、_________、__________和_____________。
下表是市场上销售的一种常见氮肥的包装说明书。请阅读有关内容后,回答下列问题:
| 主要成分 |
NH4Cl |
| 保存方法 |
干燥阴凉处存放 |
| 含氮量 |
≥25% |
(1)NH4Cl和K2SO4都是可作化学肥料的物质。虽然它们没有共同的组成元素,但在物质(化合物)的分类中它们同属于_____________类。
(2)化学肥料通常所说的“含氮量”中的“氮”是指___________。(填序号)
| A.氮分子 | B.氮原子 | C.氮离子 | D.氮元素 E.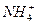 |
(3)请根据上述氮肥的保存方法,推测NH4Cl的性质之一是__________________________。
(8分)2001年11月13日至18日短短6天中,山西省接连发生四起小煤矿瓦斯爆炸事故,造成58人死亡,多人受伤。据报道,发生事故的4家煤矿均属应关停之列。国家针对小煤矿的“关井压产”曾多次发出整治通知,但由于近期煤炭价格上涨,加之乡镇煤矿的停产整顿会直接影响当地财政税收,致使一些小煤矿矿主置工人生命安全于不顾,暗中又恢复了生产。 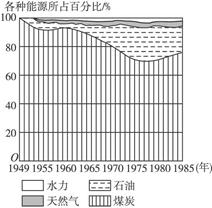
(1)上图所示,1985年煤炭占我国能源消耗的百分比约为________%。
(2)在煤炭的形成过程中会产生瓦斯。瓦斯的主要成分是甲烷。请写出瓦斯爆炸主要反应的化学方程式:________________________________________________________________。
(3)爆炸后,坑道内CO气体含量达10%以上,引起人体CO中毒。现场抢救CO中毒者,应立即采取什么措施?
(6分)航天领域中使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点。氢-氧燃料电池有酸式和碱式两种,它们放电时的电池总反应方程式可表示为2H2+O2====2H2O。酸式氢氧燃料电池的电解质是酸,其负极反应可表示为:2H2 4H++4e-;则其正极反应可表示为;碱式氢-氧燃料电池中的电解质是碱,其正极反应可表示为O2+2H2O+4e-
4H++4e-;则其正极反应可表示为;碱式氢-氧燃料电池中的电解质是碱,其正极反应可表示为O2+2H2O+4e- 4OH-,则其负极反应可表示为__________________________。
4OH-,则其负极反应可表示为__________________________。
在核电荷数为1—18的元素中,其单质属于金属晶体的有_______,金属中,密度最小的是_______,地壳中含量最多的金属元素是_______,熔点最低的是_______,既能与酸反应又能与碱反应的是_______,单质的还原性最强的是_______。