氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知: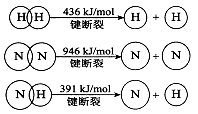
①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K .(填“增大”、“减小’’或“不变”)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。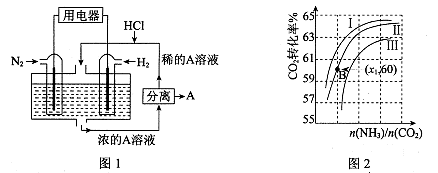
(4)用氨合成尿素的反应为2NH3(g)+CO2(g)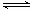 CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比 、水碳比
、水碳比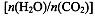 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料.以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
请填空:
(1)一定条件下,反应室1中发生反应CH4(g)+H2O(g)═CO(g)+3H2(g)△H>0.其它条件不变,只降低温度,逆反应速率将 (填“增大”、“减小”或“不变”).
(2)图1中反应室3(容积可变的密闭容器)中0.2mol CO与0.4mol H2在催化剂作用下发生可逆反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图2所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图2所示,则:
①P1 P2(填“<”、“>”或“=”).
②在压强P1下,100℃时反应达到化学平衡,反应室3的容积变为2L,此时CO平衡常为 , 若温度不变,再加入1.0mol CO后重新达到平衡,CO的平衡转化率 (填“增大”、“不变”或“减小”).
③保持容积为2L不变,温度100℃不变,向反应室3中再通入0.2mol CO与0.4mol H2,CO的平衡转化率 (填“增大”、“不变”或“减小”).
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在一定体积的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L•min);
(2)氢气的转化率= ;
(3)下列措施中能使平衡体系中 减少的是 .
减少的是 .
A.将H2O(g)从体系中分离出去
B.充入He(g),使体系压强增大
C.升高温度
D.再充入1molH2
(4)下列不能表示反应达到平衡状态的是
A.体系压强不再改变
B.混合气体的密度不再改变
C.容器内的温度不再改变
D.混合气体的平均分子质量不再改变
E.V(CO2):V(H2O)=1:1
F.混合气体的总物质的量不再改变
(1)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率,某同学设计实验如表所示:
| 0.01mol•L﹣1 KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol•L﹣1 Na2SO3溶液的体积/mL |
H2O的体积 /mL |
实验 温度 /℃ |
溶液出现蓝色时所需时间/s |
|
| 实验1 |
5 |
V1 |
35 |
25 |
|
| 实验2 |
5 |
5 |
40 |
25 |
|
| 实验3 |
5 |
5 |
V2 |
0 |
该实验的目的是 ,表中V1= mL.
(2)可逆反应C(s)+H2O(g) H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.
H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是 、 ;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
(1)若5.2g乙炔(C2H2气态)完全燃烧生成液态水和CO2(g)时放热260kJ.该反应的热化学方程式为 ;乙炔的燃烧热为
(2)已知拆开1molH﹣H键,1molN﹣H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
(3)已知:0.3moL气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出649.5KJ热量,请写出乙硼烷燃烧的热化学方程式 ;又已知:H2O(l)→H2O(g);△H=+44kJ/moL,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是 .
Na2O2和H2O2是两种重要的化工原料,可以用作航天飞行器和潜艇中的生氧剂。已知,Na2O2和H2O2中O元素的化合价都是-1价,并且-1价的氧极其不稳定,易转化为-2价或0价的氧 。在下列反应(反应未配平)中
A.Na2O2+HCl H2O2+NaCl H2O2+NaCl |
B.Ag2O+H2O2 Ag+O2+H2O Ag+O2+H2O |
C.H2O2 H2O+O2 H2O+O2 |
D.H2O2+Cr2(SO4)3+KOH K2SO4+H2O+K2CrO4 K2SO4+H2O+K2CrO4 |
(1)H2O2仅体现氧化性的反应为 (填代号,下同);
(2)H2O2仅体现还原性的反应为 ;
(3)H2O2既不表现氧化性,又不表现还原性的为 ;
(4)H2O2既表现氧化性,又表现还原性的为 ;。