降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在一定体积的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.

(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L•min);
(2)氢气的转化率= ;
(3)下列措施中能使平衡体系中 减少的是 .
减少的是 .
A.将H2O(g)从体系中分离出去
B.充入He(g),使体系压强增大
C.升高温度
D.再充入1molH2
(4)下列不能表示反应达到平衡状态的是
A.体系压强不再改变
B.混合气体的密度不再改变
C.容器内的温度不再改变
D.混合气体的平均分子质量不再改变
E.V(CO2):V(H2O)=1:1
F.混合气体的总物质的量不再改变
物质A、B、C、D为中学常见单质,其组成元素的原子序数依次减小,且其中只有三种是短周期元素,B为黄绿色气体。试根据下图中物质的相互转化关系回答下列问题。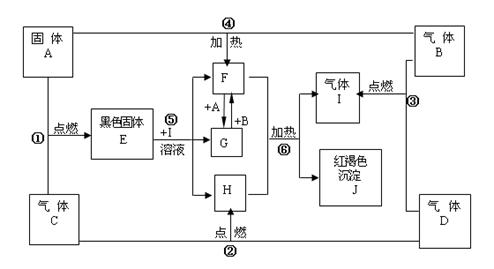
(1)A是_________
(2)在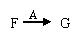 的转化中,A的作用是;在①~⑥的反应中,不属于氧化
的转化中,A的作用是;在①~⑥的反应中,不属于氧化 还原反应的是。(多填或少填无分)
还原反应的是。(多填或少填无分)
(3)写出A在高温下与H反应的化学反应方程式并标出电子转移的方向和数目
。
(4)写出反应⑥的化学反应方程式 。
(5)已知在101 kPa 条件下,2 mol D完全燃烧生成液态生成物放出571.6 kJ热量;请书写表示D燃烧热的热化学方程式:
(14分)D、E为中学化学常见的金属单质,在一定条件下C、D间能发生反应.各物质转化关系如下图: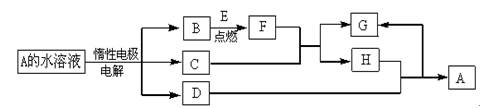
⑴B的同素异形体的名称为:_____________;H的化学式为:_____________.
⑵写出D与H反应的离子方程式_____________.
⑶用惰性电极电解A 溶液的阳极反应式为:_____________.
⑷检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________.
a.氯水和KSCN溶液 b.氢氧化钠溶液 c.酸性KMnO4溶液
⑸用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入9.8 g含A中金属阳离子的弱碱固体后恰好恢复到电解前的浓度和pH.则电解过程中转移电子的物质的量为_____________mol, 收集到标准状况下的气体体积为_____________.
(15分)
已知G是合成某高分子化合物的原料,只含C、H、O三种元素,5.9g物质G能与1mol/LNaOH的溶液100mL恰好完全反应,0.1mol物质G与足量金属钠反应在标准状况下生成2.24L氢气,分子结构中含有一个甲基,A的分子式为C8H13O2Br,有机物A、B、C、D、E、F、G之间的相互转化关系如图所示:
⑴写出C的结构简式:.
⑵A中官能团名称是:.
⑶B的同分异构体中属于酯的有多种,任写其中三种属于酯类的结构简式:
,,.
⑷写出D→E化学反应方程式:.
⑸写出反应①化学反应方程式:
⑹写出由F和G 在一定条件下合成高分子化合物的化学反应方程式:
.
(15分)
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1="738kJ/mol" I2 =" 1451" kJ/mol I3 =" 7733kJ/mol" I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
⑴已知BA5为离子化合物,写出其电子式.
⑵B基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形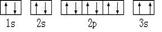 ⑶某同学根据上述信息,推断C基态原子的核外电子排布为:
⑶某同学根据上述信息,推断C基态原子的核外电子排布为:
该同学所画的电子排布图违背了.
⑷G位于族区,价电子排布式为.
⑸DE3 中心原子的杂化方式为,用价层电子对互斥理论推测其空间构型
为.
⑹检验F元素的方法是,请用原子结构的知识解释产生此现象的原因是.
⑺若某单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为,该单质晶体中原子的堆积方式为四种基本模式中的.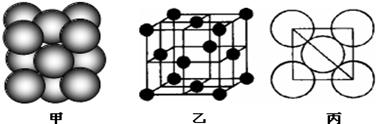
(15分)
沿海地区有着丰富的海水资源,海水占地球总储水量的97.4﹪,海水是人类宝贵的自然资源,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海水资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:
⑴请列举海水淡化的两种方法、。
⑵使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式.
⑶步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是:.
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
⑷在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
.
⑸电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是
| A.H2 | B.CO2 | C.空气 | D.O2 E.水蒸气 |
⑹苦卤(海水蒸发结晶分离出食盐后的母液)中含有较多的NaCl、MgCl2、KCl、MgSO4等物质.用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有
.