(15分)
沿海地区有着丰富的海水资源,海水占地球总储水量的97.4﹪,海水是人类宝贵的自然资源,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海水资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:
⑴请列举海水淡化的两种方法 、 。
⑵使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 .
⑶步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是: .
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
⑷在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
.
⑸电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是
| A.H2 | B.CO2 | C.空气 | D.O2 E.水蒸气 |
⑹苦卤(海水蒸发结晶分离出食盐后的母液)中含有较多的NaCl、MgCl2、KCl、MgSO4等物质.用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有
.
(1)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O。当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为。
(2)氨气的制备与运输过程中都有严格要求。运输时,严禁与卤素(如Cl2)混装运输。若二者接触时剧烈反应产生白烟,若0.4 mol NH3参加反应时有0.3 mol 电子转移,写出反应的化学方程式____。
[化学—选修5:有机化学基础](15分)
高分子材料PET聚酯树脂和PMMA的合成路线如下:
已知:Ⅰ.RCOOR′+ R′′18OH 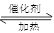 RCO18O R′′+ R′OH(R、R′、R′′代表烃基)
RCO18O R′′+ R′OH(R、R′、R′′代表烃基)
|
Ⅱ.(R、R′代表烃基)
(1)①的反应类型是________。 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
[化学—选修3:物质结构与性质](15分)
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为________(填元素符号),其原因为______。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;1 mol B2A4分子中含__________molσ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为__________,乙为_____________;高温时,甲易转化为乙的原因为__________________。
[化学—选修2:化学与技术](15分)
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是(填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O—NaBr + NaBrO3+NaHCO3,吸收1mol Br2时,转移的电子数为mol。
(3)海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为,产品2的化学式为,1L浓海水最多可得到产品2的质量为g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式。
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件(填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为:。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:①CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
②CH3OH(g)=CH3OH(l)△H=-b kJ·mol-1;
③2H2(g)+O2(g)=2H2O(g)△H=-c kJ·mol-1;
④H2O(g)=H2O(l)△H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________