(1)①常温下,某溶液中由水电离出的c (OH-)=1.0×10-10mol/L,该溶液可以是 。(填选项)
| A.pH= 4的醋酸 |
| B.pH=10的NaOH溶液 |
| C.pH=9的Na2CO3溶液 |
| D.pH= 2的硫酸 |
E.pH= 4的NH4Cl溶液
(2)在100℃时,将100mL 0.1mol/L的稀H2SO4溶液与100mL 0.4mol/L的NaOH溶液混合后,溶液的pH= 。(混合时溶液体积变化忽略不计)
(3)常温下,a mL 0.1mol/L盐酸与b mL 0.1mol/L氨水混合,充分反应。若混合后溶液呈中性,
则a b(填“<”、“=”或“>”)。
(4)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应。若a=b,则反应后溶液中离子浓度从大到小的顺序是 。
(5)氯化铝水溶液呈酸性 ,原因是(用离子方程式表示):______________________。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(6)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
已知烯烃、炔烃在臭氧的作用下发生以下反应:
CH3—CH=CH—CH2—CH=CH2―→CH3CHO+OHC—CH2—CHO+HCHO
CH3—C≡C—CH2—C≡CH―→CH3COOH+HOOCCH2COOH+HCOOH
某烃分子式为C10H10,在臭氧作用下发生反应:
C10H10―→CH3COOH+3HOOC—CHO+CH3CHO
(1)C10H10分子中含有________个双键,________个三键
(2)C10H10分子结构简式为________。
有机物A满足下列条件:
①它在空气中完全燃烧的产物是CO2和H2O,且燃烧过程中产生CO2的物质的量等于消耗掉O2的物质的量,也正好和生成H2O的物质的量相等;
②质谱显示A的分子离子峰质荷比为180,分子中含有六元环;
③碳和氧原子在分子结构中都有两种不同的化学环境,A的核磁共振氢谱中有3个吸收峰。
回答下列问题:
(1)A的实验式(最简式)是________;
(2)A的分子式是________;
(3)A的结构简式是________;
(4)A有一种同分异构体B,其分子中也有六元环,所有碳原子都处于相同化学环境,其结构简式是________。
现拟分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作步骤流程图。请填入适当的试剂、分离方法以及所分离的有关物质的名称。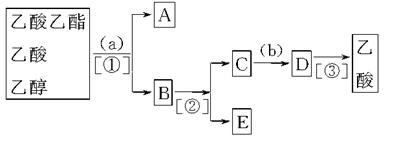
(1)a________,b________;
(2)①________,②________,③________;
(3)A________,B_________;C________;D_______,E_______。
(1)用系统命名法命名烃A:_______________________________;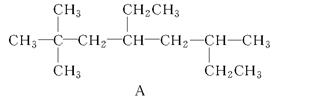
烃A的一氯代物具有不同沸点的产物有________种。
(2)有机物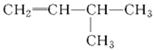 的系统名称是,将其在催化剂存在下完全氢化,所得烷烃的系统名称是。
的系统名称是,将其在催化剂存在下完全氢化,所得烷烃的系统名称是。
(3)有机物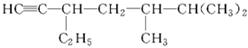 的系统名称是,将其在催化剂存在下完全氢化,所得烷烃的系统名称是。
的系统名称是,将其在催化剂存在下完全氢化,所得烷烃的系统名称是。
如图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。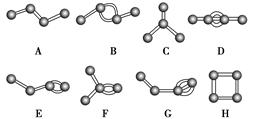
(1)图中属于烷烃的是________(填字母)。
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成________和________;不仅可以形成________,还可以形成碳环。
(3)上图中互为同分异构体的是:A与_____________________。B与________;D与________(填字母)。