[化学—选修3:物质结构与性质](15分)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。F是第四周期元素,F原子的基态电子排布中有4个未成对电子;
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,C元素的气态氢化物的VSEPR模型为 。B2A4是重要的基本石油化工原料,1 mol B2A4分子中含__________molσ键。
(4)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 。
(5)已知D、E能形成晶胞如图所示的两种化合物,

化合物的化学式,甲为__________,乙为___________;高温时,甲易转化为乙的原因为_____________。
 短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示,其中A为地壳中含量最高的金属元素。
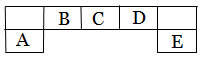
请用化学用语回答下列问题: (1)D元素在周期表中的位置:
(1)D元素在周期表中的位置:
(2)A、D 、E元素简单离子半径由大到小的顺序为_____>______ >______ (填微粒符号 ) (3)F与D同主族且相邻,其气态氢化物稳定性的大小>(填微粒符号)
(3)F与D同主族且相邻,其气态氢化物稳定性的大小>(填微粒符号)
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的电子式,该阳离子中存在的化学键有。 (5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因.
(5)C元素的简单氢化物与E元素的最高价氧化物的水化物反应,生成化合物K,则K的水溶液显_____性(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因.
(6) 化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式。
化合物AC导热性好,热膨胀系数小,是良好的耐热冲击材料。其中制备AC的一种方法为:用A元素的氧化物、焦炭和C的单质在1600 ~ 1750℃生成AC,每生成1 mol AC,消耗18 g碳,吸收b kJ的热量。(热量数据为25℃、101.3 kPa条件下)写出该反应的热化学方程式。
(7)在Fe和Cu的混合物中加入一定量C的最高价氧化物的水化物稀溶液,充分反应后,剩余金属m1 g;再向其中加入稀硫酸,充分反应后,金属剩余 m2 g 。下列说法正确的是。
a.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Cu2+
b.加入稀硫酸前和加入稀硫酸后的溶液中肯定都有Fe2+
c.m1一定大于m2
d.剩余固体m1 g 中一定有单质铜,剩余固体m2 g 中一定没有单质铜
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下: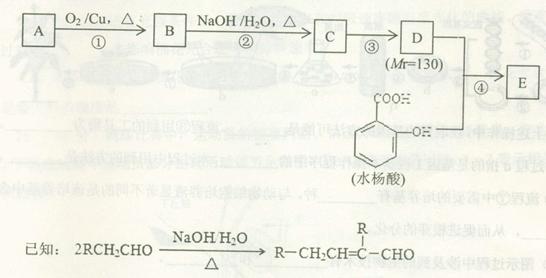
请回答下列问题:
(1)A是分子式为C4H10O的一元醇,分子中只有一个甲基。F与A互为同分异构体,F的核磁共振氢谱图有2组峰,且峰面积比为9:1。则F与浓HBr溶液共热生成有机物的结构简式为。
(2)B能与新制的Cu(OH)2悬浊液发生反应,该反应的化学方程式为。
(3)C中所含官能团的名称为,若要检验C中所含官能团,一次取样检验,按使用试剂的先后顺序,下列选项中组(填字母编号)更为合理。
a.银氨溶液、溴水 b.溴水、银氨溶液
c.银氨溶液、稀盐酸、溴水 d.溴水、氢氧化钠溶液、银氨溶液
(4)第③步的反应类型为。
(5)同时符合下列条件的水杨酸的同分异构体有种。
a.分子中含有6个碳原子在同一条直线上
b.分子中所含官能团包括水杨酸具有的含氧官能团
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下: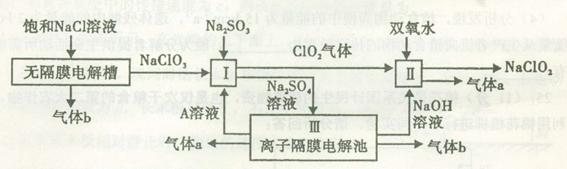
(1)A的化学式是,装置III中A在极区产生。
(2)II中反应的离子方程式是。
(3)通电电解前,检验III中阴离子的方法和步骤是。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是 (填字母编号)。
a.Na2O2b.FeCl2c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07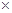 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中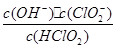 = 。
= 。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g) Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是(填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是(填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
B.缩小容器容积,平衡右移, H减小 H减小 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 |
| D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+ O2(g)=CO(g)
O2(g)=CO(g) H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1
C(s)+ O2(g)=CO2(g) H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1
S(s)+O2(g)=SO2(g) H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1
则SO2(g)+2CO(g)=S(s)+2CO2(g) H=。
H=。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是(填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为L。
有机物A的分子式为C9 H10 O2,A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):
其中K物质与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构。
已知:①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH→RCH2CHO;
② —ONa连在烃基上不会被氧化。
请回答下列问题:
(1)F与I中具有相同的官能团,检验该官能团的试剂是。
(2)上述变化中属于水解反应的是(填反应编号)。
(3)写出结构简式,G:,M:。
(4)写出下列反应的化学方程式:反应①:,K与少量的氢氧化钠溶液反应:。
(5)同时符合下列要求的A的同分异构体有种。
I.含有苯环Ⅱ.能发生银镜反应和水解反应
Ⅲ.在稀氢氧化钠溶液中,1mol该同分异构体能与1mol NaOH反应