亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下: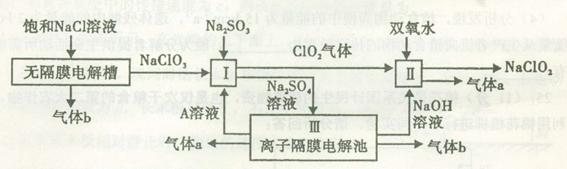
(1)A的化学式是 ,装置III中A在 极区产生。
(2)II中反应的离子方程式是 。
(3)通电电解前,检验III中阴离子的方法和步骤是 。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是 (填字母编号)。
a.Na2O2 b.FeCl2 c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07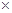 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中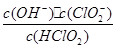 = 。
= 。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是
已知化学反应N2+3H2 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,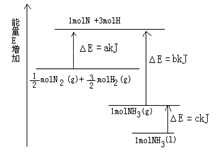
(1)1mol N 和3mol H 生成1mol NH3(g)是能量的过程(填“吸收”或“释放”)。
(2)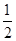 N2(g)+
N2(g)+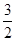 H2(g)
H2(g)  NH3(g )△H=;
NH3(g )△H=;
(3)N2(g)和H2生成NH3(1)的热化学方程式为
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_________________________________
________________________________________________________________________。
(2)要加快上述实验中气体产生的速率,还可采取的措施有______________________
__________________________________________________________________(答两种)。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量锌粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol/LH2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
其中:V1=,V6 ,V9=。
在密闭容器里,通入x mol H2和y mol I2 (g),改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1) 升高温度;
(2) 加入催化剂;
(3) 充入更多的H2;
(4) 扩大容器的体积;
(5) 容器容积不变,通入氖气。
把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如右图所示图中t1~t2速率变化的主要原因是__________,t2~t3速率变化的主要原因是。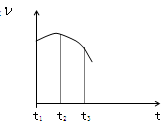
2SO2(g)+O2 (g)= 2SO3 (g),反应过程的能量变化如图所示。已知:1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ/mol。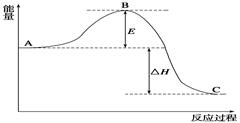
请回答下列问题:
(1)图中A、C分别表示、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
(2)图中ΔH= kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)= mol/(L·min);
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程)。